Что разъедает стекло. Какая кислота разъедает стекло
- Что разъедает стекло. Какая кислота разъедает стекло
- Плавиковая кислота растворяет человека. Плавиковая кислота. Свойства и применение плавиковой кислоты
- Почему плавиковая кислота слабая. Ответы
- Плавиковая кислота сильная или слабая. Разница между Плавиковой кислотой и Соляной кислотой
- Фтористоводородная кислота, что растворяет. Влияние фторида водорода на организм человека. Водный раствор фтороводорода
- Плавиковая кислота нейтрализация. Как правильно утилизировать кислоты
- Видео КИСЛОТА, РАСТВОРЯЮЩАЯ СТЕКЛО!
Что разъедает стекло. Какая кислота разъедает стекло
Еще из курса школьной химии мы помним, что все мензурки и колбы в школьной лаборатории были сделаны из стекла, поскольку оно не вступает в реакцию с большинством активных соединений, таких как кислоты.
Кислоты взаимодействуют в основном с металлами, щелочами и солями, а стекло - это уже окисленный кремний, окислить его второй раз не получится .
Кроме того, кремний и кислород с стекле связаны очень прочно, и разорвать такую связь очень трудно.
Чем же она лучше или может быть сильнее?
Вовсе нет, просто процесс идет немного по другому.
Атомы кислорода во время реакции замещаются фтором, который является еще более сильным окислителем ( SiO2+4HF=SiF4(стрелка вверх) +2H2O ). На выходе получается тетрахлорид кремния (газ) и вода.
Название «плавиковая» происходит от названия минерала - плавикового шпата (СаF2), из которого получают фтороводород.
Уникальной особенностью плавиковой кислоты является способность растворять стекло.
Поэтому плавиковую кислоту хранят не в стеклянной посуде, а в сосудах с пластиковым или тефлоновым покрытием.
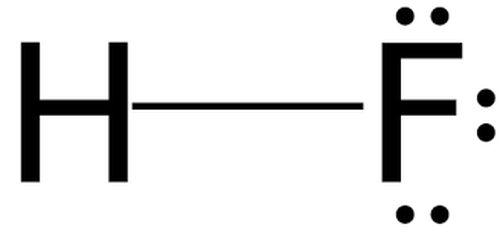 Плавиковая кислота, хотя и не является сильной кислотой, сильно ядовита
Плавиковая кислота, хотя и не является сильной кислотой, сильно ядовита Обладает слабым наркотическим действием.
При попадании на кожу в первый момент не вызывает сильной боли, легко и незаметно всасывается, но через короткое время вызывает отёк, боль, химический ожог и общетоксическое действие.
Симптомы от воздействия слабо концентрированных растворов могут появиться через сутки и даже более после попадания их на кожу.
При этом антидоты практически отсутствуют.
Поэтому при получении кожей смертельной дозы фтороводорода человек может жить несколько суток на обезбаливающих, но без надежды на спасение.
Плавиковая кислота растворяет человека. Плавиковая кислота. Свойства и применение плавиковой кислоты

Плавиковая кислота и флюорит . Где взаимосвязь? На этот вопрос ответили шведский химик Карл Шееле и англичанин Джозеф Пристли.
Сам камень был известен еще Георгию Агриколе – отцу минералогии, жившему в 15-ом веке. Он-то и нарек его флюоритом , от латинского fluor – «течь».

Имя объясняется применением породы в качестве флюса . Его добавка к шихте снижает температуру ее плавления.
Так древние решали проблему обработки металлов. А где пригодилась названая по аналогии с камнем кислота , и чем, собственно, она является?
Что такое плавиковая кислота
Формула плавикового шпата – CaF2. В кислоту переходит лишь фтор , соединяясь с водородом. Получается фтороводород.
То есть, у плавиковой кислоты формула HF. Промышленниками, как правило, используется раствор. Но, соединение может быть и безводным.
Такую форму впервые получили Гей Люссак и Жозеф Луи. Это французские химик и физик. Безводную плавиковую кислоту они представили миру в 1810-ом году.
Когда-то, растворы плавиковой кислоты стали двойным открытием. Фтор, находящийся в составе соединения, был не известен ученым.
Работая с кислотой, они поняли, что по активности вещество подобно хлору . Название нового элемента «фтор» закрепилось лишь в России , переводится с греческого, как «разрушающий». В остальном мире элемент именуют флюором.
Внешне фтороводород можно определить лишь по туману, который газообразное соединение образует с влажным воздухом.
Выдает безводную кислоту и запах. У фтора он сильный и резкий. В остальном, фтороводород неуловим, поскольку бесцветен, смешивается с атмосферой.
Водный раствор фтороводорода тоже бесцветен, по консистенции жидкий. Плотность плавиковой кислоты равна 1,2 грамма на кубический сантиметр.
Показатель воды меньше лишь на 0,1 грамма на кубический сантиметр. Поэтому, есть риск перепутать соединение с чистой водой.
Последствия могут быть катастрофическими. Плавиковая кислота – опасность для человека. Почему? Об этом поговорим в следующей главе.
Свойства плавиковой кислоты
Фтороводород считается самой сильной из кислот, уступая в реакционности лишь царской водке .
Последняя, является смесью реактивов. В царской водке соединились сильные азотная и соляная кислоты.
Сила плавиковой кислоты демонстрируется в воздействии на стекло . Это инертный материал, не подвластный другим кислотам.
Плавиковая же стекло плавит. Это заметил еще Шванквард — немецкий химик, живший в 17-ом столетии. Проводя опыты, он использовал сосуд из флюорита.
Налив в него однажды серную кислоту, он заметил, что стеклянная крышка начала плавиться. Реагент в сосуде не мог произвести такое действие.
Значит, в серной кислоте частично растворился плавиковый шпат, и что-то из его состава стало разъедать крышку. Этот вывод Шванкварда, собственно, и стал причиной поиска новой кислоты.
Если растворившись в соляной кислоте соль плавиковой кислоты разъела стекло, что мешает ей разъесть органику?
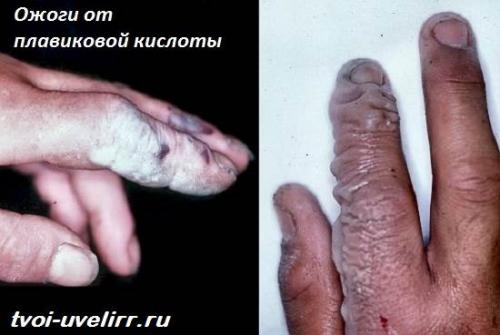
Ничего. Попадая на кожу и слизистые, реагент разрушает их. Итогом становятся ожоги. Более того, реагент и его пары запускают мутагенные процессы в крови .
Выявлен слабый наркотический эффект. Все вкупе дает 2-ой класс опасности. Он присвоен кислоте официально.
Попадая на кожу, фторводород не вызывает мгновенной боли. Соединение незаметно всасывается клетками.
Отек начинается примерно через 5-10 минут. Одновременно приходит боль, химический ожог.
Если контакт связан со слабым раствором реагента, симптомы могут проявиться, лишь через сутки.
Антидота, то есть, противоядия, нет. Получив смертельную дозу фтороводорода, надежды на спасение нет. Продержаться получается лишь несколько дней, и то на наркотиках.
Разъедая стекло , прочие силикатные материалы, органику, плавиковая кислота не вступает во взаимодействие с пластиком.
Именно в нем реагент и транспортируют. Не взаимодействует с фтороводородом и парафин.
Можно ли заменить тару из него или полиэтилена металлической? Зачастую, нет. Фтороводород вступает в реакцию с большинством металлов.
Среди немногих исключений – свинец . Но, он слишком тяжел и дорогостоящ, чтобы быть альтернативой пластику.
Остается узнать, куда везут плавиковую кислоту, где она пригождается, если столь опасна.
Применение плавиковой кислоты
Плавиковая кислота применение , естественно, находит в стекольной промышленности.
Реагент используют для химической полировки изделий и освобождения металлических деталей от примесей кварца и керамики.
Поскольку кремний плавиковая кислота плавит, обрабатывать можно и хрусталь , убирая с его поверхности все шероховатости.
В качестве протравливающего вещества реагент используют, так же, в зуботехнической отрасли.
Плавиковая кислота в стоматологии убирает с внутренней стороны керамических протезов лейцит.
Это породообразующий минерал магматического происхождения. Он – часть металлической подложки под слоем керамики.
Почему плавиковая кислота слабая. Ответы
Nico
Путаница возникает из термина « слабый» , который следует интерпретировать только в терминах химии.
Слабая кислота, как вы говорите, просто означает, что кислота не легко диссоциирует, а не то, что ее действие слабое! Проще говоря, HF разъедает стекло, что не делает даже HCl.
Плавиковая кислота является очень едкой жидкостью и является контактным ядом. С ним следует обращаться с особой осторожностью, помимо того, что присуще другим минеральным кислотам. Вследствие своей низкой константы диссоциации HF как нейтральная жирорастворимая молекула проникает в ткани быстрее, чем типичные минеральные кислоты. Из-за способности плавиковой кислоты проникать в ткани, отравление может происходить легко через воздействие на кожу или в глаза, а также при вдыхании или проглатывании. Симптомы воздействия плавиковой кислоты могут не проявляться сразу. HF влияет на нервную функцию, а это означает, что ожоги изначально не могут быть болезненными. Случайные воздействия могут остаться незамеченными, задерживая лечение и увеличивая степень и серьезность травмы.
После попадания в кровь через кожу он вступает в реакцию с кальцием крови и может вызвать остановку сердца. Ожоги с площадью более 25 квадратных дюймов (160 см2) могут вызвать серьезную системную токсичность из-за влияния на уровень кальция в крови и тканях. В организме плавиковая кислота реагирует с вездесущими биологически важными ионами Ca2 + и Mg2 +. Образование нерастворимого фторида кальция предлагается в качестве этиологии как для резкого падения кальция в сыворотке, так и для сильной боли, связанной с токсичностью в тканях.
Плавиковая кислота сильная или слабая. Разница между Плавиковой кислотой и Соляной кислотой
Ключевое различие между Плавиковой кислотой и Соляной кислотой состоит в том, что Плавиковая кислота является слабой кислотой , тогда как Соляная кислота является сильной кислотой. Кроме того, Плавиковая кислота способна образовывать водородные связи, в то время как Соляная кислота не способна образовывать водородные связи.
Еще одно важное различие между Плавиковой кислотой и Соляной кислотой заключается в их молекулярной структуре. Молекула Плавиковой кислоты имеет ион фтора, тогда как молекула соляной кислоты имеет ион хлора. Кроме того, плавиковая и соляная кислоты являются донорами протонов. Следовательно, эти молекулы кислоты могут ионизироваться в водных средах с выделением протонов (H+). Эти протоны вызывают кислотность в водной среде.
- Обзор и основные отличия
- Что такое Плавиковая кислота
- Что такое Плавиковая кислота
- В чем разница между Плавиковой кислотой и Соляной кислотой
- Заключение
Что такое Плавиковая кислота?
Плавиковая кислота — это раствор фтористого водорода с водой. Фтористый водород представляет собой кислотное соединение, имеющее химическую формулу HF и молярную массу 20 г/моль. Кроме того, эта кислота является исходным соединением практически для всех фторсодержащих соединений. Пример: тефлон. Эта кислота обладает высокой химической активностью по отношению к стеклу и умеренно активной по отношению к металлам. Поэтому она хранится в пластиковых контейнерах. К онтейнер из тефлона слегка проницаем для этой кислоты.

Плавиковая кислота
Плавиковая кислота является слабой кислотой, так как она имеет более низкую константу диссоциации. Диссоциация этой кислоты дает ионы гидрония (комбинация протонов и молекул воды образуют ионы гидрония) и ионы фтора. Среди галогенводородных кислот это единственная слабая кислота. П олучают эту кислоту путем добавления концентрированной серной кислоты к минеральному флюориту (CaF2).
Что такое Соляная кислота?
Соляная кислота представляет собой водный раствор хлористового водорода. Хлористый водород имеет химическую формулу HCl, её молярная масса составляет 36,5 г/моль. Эта кислота имеет резкий запах. Она применяется в качестве исходного соединения для многих неорганических химических веществ, таких как винилхлорид.

Соляная кислота
В отличие от HF, HCl является сильной кислотой, которая может полностью ионизироваться в водной среде, образуя ионы гидроксония и ионы хлорида. Таким образом, эта кислота имеет высокое значение Ka. Получают эту кислоту, из газообразного хлороводорода путём растворения его в воде.
В чем разница между Плавиковой кислотой и Соляной кислотой?
Плавиковая кислота — это раствор фтористого водорода с водой. Это слабая кислота, и она может образовывать водородные связи. Соляная кислота — водный раствор хлористового водорода. Это сильная кислота, и она не может образовывать водородные связи.
Кроме того, молекула Плавиковой кислоты имеет ион фтора, тогда как молекула Соляной кислоты имеет ион хлора. При этом, обе они являются галогенводородными кислотами, у которых атом водорода связан с галогеном. Плавиковая кислота является единственной слабой кислотой среди других галогеноводородных кислот.
Заключение — Плавиковая кислота против Соляной кислоты
Плавиковая и Соляная кислота являются галогенводородными кислотами, так как оба этих кислотных соединения имеют галогенид, связанный с атомом водорода. Разница между Плавиковой кислотой и Соляной кислотой заключается в том, что Плавиковая кислота является слабой кислотой и может образовывать водородные связи, тогда как Соляная кислота является сильной кислотой и не способна образовывать водородные связи.
Фтористоводородная кислота, что растворяет. Влияние фторида водорода на организм человека. Водный раствор фтороводорода
Фтороводород (HF) — негорючее бесцветное вещество с резким раздражающим запахом, дымит на воздухе. Попадая в организм человека, оказывает токсичное воздействие. В реакции с соединениями может вызвать пожар или взрыв. Растворяясь в воде, образует фтороводородную кислоту.
Образование HF может быть связано со взрывом при взаимосвязи с водородом, в процессе взаимодействия плавикового шпата и сильных нелетучих кислот. Процедура выполняется в печах из стали при 120-300 градусах C, и занимает много времени. Установочные части, предназначенные для вбирания HF, производятся из свинца.
Водный раствор фтороводорода
В сжиженном виде фтористый водород представляет собой плавиковую кислоту, и применяется как 40-72 %-ный раствор. В ней могут содержаться примеси железа, мышьяка, сернистого газа. Концентрация 60 % раствора участвует в химии органического синтеза. Хранение смеси производится в полиэтиленовых или тефлоновых сосудах, а многотоннажная плавиковая кислота транспортируется в резервуарах из стали. Применяется при производстве кремнефторидов, синтетических смазочных масел и борфторида аммония, который служит компонентом флюсов в металлургии. Используется при электролизе для получения чистого бора, цементов и эмалей, не восприимчивых к минеральным кислотам. Флюаты обеспечивают водонепроницаемость стройматериалов. Большую значимость имеет раствор в матировании стекла и полупроводниковой индустрии, участвуя в травлении кремния. Используется для получения криолита, фтористых производных урана, фреонов. При добавлении в примесь акцепторов фтора образуются сверхкислые среды. В нефтехимической промышленности раствор необходим для обработки и очистки поверхностей. Применяется в призабойных зонах добывающих скважин. В сочетании с прочими кислотами счищает со стенок аппаратуры отложения асфальтов и парафинов, что увеличивает эффективность нефтедобычи. Присутствует в системах фильтрации.
Влияние фторида водорода на человека
Вещество ядовито и представляет большую опасность для человека, как в состоянии газа, так и виде жидкости. Плавиковая кислота оказывает наркотическое воздействие, и пагубно сказывается на работе сердечно-сосудистой, выделительной, дыхательной системы, поражает кожные покровы и слизистые оболочки. Отравление смесью через кожные покровы протекает безболезненно, симптомы проявляются на следующий день: образование язв на участках кожи и ожогов на слизистой глаз. Попадание в организм путем вдыхания, влечет за собой разрушение тканей легких. При острой интоксикации первой помощью является 2 % раствор СаСЬ. При ожогах пострадавшую область необходимо долгое время промывать под струей холодной воды, после чего наложить компресс 20 %-ной взвеси MgO в глицерине.
Обеспечение безопасности при работе с HF
В промышленном производстве возможны утечки высокотоксичного вещества FH, поэтому должна проводиться постоянная проверка концентрации фтороводорода в рабочем помещении. ПДК на заводских объектах с барабанными печами, составляет 0, 1 мг/м3. Для контроля содержания ядовитого газа в воздухе на предприятиях должно быть установлено специальное газоаналитическое оборудование, наиболее востребованное на рынке КИПиА: Vector , Бинар-1П , ИГМ-13 , Лидер 021 , Лидер 041 , Микросенс М3 , ПГУ-А , ССС-903МТ , ССС-903МЕ , Хоббит-Т переносной , Эколаб , ОКА-92МТ . Данные приборы вовремя оповестят персонал о превышении допустимого порога концентрации примеси, что поможет избежать отравления сотрудников, а также исключит вероятность взрывов и пожаров в здании.
Качественную и надежную аппаратуру можно приобрести в компании RTECO — проверенного поставщика КИПиА известных производителей.
Дополнительными средствами индивидуальной защиты от ядовитых примесей в воздухе являются респираторы, фильтрующие и изолирующие противогазы. Для защиты от химических и термических ожогов при работе со смесью нужно пользоваться шерстяной спецодеждой, резиновой обувью, перчатками и изолирующими очками. Несоблюдение перечисленных мер может привести к аварийной ситуации на производстве, интоксикации или смерти работников.
Плавиковая кислота нейтрализация. Как правильно утилизировать кислоты
Важно! Известно, что кислоты являются ядовитыми. При неаккуратном обращении с ними, при попадании их на кожу или внутрь организма могут произойти ожоги, сильные отравления и даже летальный исход.
Процесс, касающийся утилизации таких агрессивных сред на предприятиях, начинается с емкости, в которой эти вещества перевозятся и хранятся. Требования к таре при утилизации:
- Строго должны соблюдаться условия герметичности тары (она должна быть полностью герметичной), на нее должна быть нанесена специальная маркировка.
- Контейнер должен быть изготовлен из материала, инертного по отношению к перевозимым в нем веществам во избежание повреждения самого контейнера.
- Запрещается осуществлять смешивание разных кислот.
- Транспортировка тары с агрессивными отходами должна производиться специальным транспортом.
Поступившие на переработку кислотные отходы нейтрализуют (обезвреживают) с помощью реагентов, что позволяет снизить концентрацию отработанных соединений до допустимого уровня. Если в «отработке» содержатся твердые примеси, то их следует отделить. Отделение производят с помощью реакционного аппарата, который имеет мешалку и камерный фильтр-пресс. Осадок, полученный в ходе процесса отделения, обычно вывозят на полигоны опасных отходов или подвергают захоронению. Оставшуюся жидкость, в зависимости от состава отработанной кислоты, направляют на дальнейшую переработку либо уничтожают.

Отработанные синильная кислота, плавиковая кислота, пикриновая кислота также подвергаются утилизации в соответствии с особенностями происходящего процесса (для каждого вещества) по всем правилам техники безопасности. Утилизация азотной кислоты протекает по описанной выше общей технологии с учетом некоторых нюансов.
Об особенностях утилизации других распространенных кислотных отходов рассказано ниже.

Источник: https://interesnyefakty.com/novosti/kakaya-kislota-rastvoryaet-steklo-kakaya-kislota-razedaet-steklo