О едком и не очень. Едкие щелочи
- О едком и не очень. Едкие щелочи
- Самая сильная кислота. СОЗДАНА САМАЯ СИЛЬНАЯ КИСЛОТА
- Соляная кислота. Свойства соляной кислоты
- Какая кислота разъедает кожу. ПЕРВАЯ ПОМОЩЬ: ХИМИЧЕСКИЙ ОЖОГ
- Плавиковая кислота растворяет человека. Отравление лимонной кислотой
- Фтороводородная кислота. Применение плавиковой кислоты
- Что разъедает щелочь. Что собой представляет
- Щелочь -- это. Значение слова «щёлочь»
- Ортофосфорная кислота. Характеристики ортофосфорной кислоты
О едком и не очень. Едкие щелочи
А конкретно — uидроксиды щелочных металлов: лития, натрия, калия, рубидия, цезия, франция, гидроксид таллия (I) и гидроксид бария. Но:
- Литий, цезий, рубидий и барий отбрасываем — дорого и редко встретишь
- Если ты, %username%, встретишь гидроксид франция, то едкость тебя будет волновать в последнюю очередь — он жутко радиоактивный
- То же и с таллием — он ядовит до жути.
А потому остались натрий и калий. Но будем откровенны — свойства у всех едких щелочей очень схожие.
Гидроксид натрия — как «каустическая сода» — известен всем. Гидроксид калия как пищевая добавка Е525 — тоже. По свойствам оба похожи: сильно гигроскопичны, то бишь тянут воду, на воздухе «расплываются». Хорошо растворяются в воде, при этом выделяется большое количество теплоты.
«Расплывание» на воздухе — по сути образование очень концентрированных растворов щелочей. А потому если положить кусочек едкой щёлочи на бумагу, кожу, некоторые металлы (тот же алюминий) — то по прошествии времени обнаружится, что материал хорошо подъело! То, что показывали в «Бойцовском клубе» — очень похоже на правду: действительно, потные руки — да в щёлочь — будет больно! Лично мне показалось больнее, чем от соляной кислоты (о ней ниже).
Впрочем, если руки очень сухие — скорее всего в именно сухой щёлочи ничего и не почувствуешь.
Едкие щёлочи отлично разваливают жиры на глицерин и соли жирных кислот — так и варят мыло (привет, «Бойцовский клуб!») Чуть дольше, но так же действенно расщепляются белки — то есть в принципе щёлочи плоть растворяют, особенно крепкие растворы — да при нагревании. Недостатком в сравнении с той же хлорной кислотой (о ней тоже ниже) является то, что все щёлочи тянут углекислый газ из атмосферы, а потому сила будет постепенно снижаться. Кроме того, щёлочи реагируют и с компонентами стекла — стекло мутнеет, хотя чтобы его всё растворить — тут, конечно, надо постараться.
К едким щелочам иногда относят и тетраалкиламмоний гидроксиды, например
Гидроксид тетраметиламмония На самом деле в этих веществах объединились свойства катионных поверхностно-активных веществ (ну это как обычное мыло — только катионное: тут активная частица дифильная частица — с зарядом «+», а в мыле — с зарядом «-«) и относительно высокая основность. Если попадёт на руки — можно намылить в воде и помыть, как мылом, если в водном растворе погреть волосы, кожу или ногти — растворятся. «Едкость» на фоне гидроксидов натрия и калия — так себе.
Самая сильная кислота. СОЗДАНА САМАЯ СИЛЬНАЯ КИСЛОТА
В университете Калифорнии (США) при участии сотрудников Института катализа со РАН (Новосибирск) создана кислота, которая в миллион раз сильнее концентрированной серной кислоты. Парадокс заключается в том, что новая кислота совершенно не агрессивна по отношению к материалам.
Соединение, названное карборановой кислотой, - первая "суперкислота", которую можно хранить в стеклянных бутылках. Такая мягкость новой кислоты обусловлена ее необычно высокой химической стабильностью. Как и все кислоты, новое вещество взаимодействует с другими соединениями, отдавая им положительно заряженный ион водорода. Однако оставшийся отрицательно заряженный анион так стабилен, что не вступает далее в реакцию. Но именно эта вторичная реакция весьма существенна при коррозии. Например, плавиковая кислота разъедает стекло, которое в основном состоит из диоксида кремния, благодаря тому, что ее отрицательно заряженный фтор-ион взаимодействует с кремнием, а ее ион водорода реагирует с кислородом.
Новая кислота - ее формула H(CHB11Cl11) - отличный донор иона водорода (протона), что и определяет "силу" кислоты. В ее растворе этих ионов гораздо больше, чем в серной или азотной кислоте. Однако карборановая часть кислоты, остающаяся после ухода иона водорода, содержит группу из 11 атомов углерода, образующих пространственную структуру икосаэдр (двадцатигранник). Такая структура - наиболее стабильная из существующих в химии групп атомов, что и объясняет коррозионную инертность кислоты.
Сверхсильная кислота не просто новое вещество, вызывающее восторг его творцов, она может быть весьма полезной с практической точки зрения. Это соединение открывает возможность синтеза "кислотных" органических молекул: соединений с добавленным к ним атомом водорода. "Кислотные" соединения на очень короткое время образуются при переваривании пищи, нефтепереработке и производстве лекарств. Карборановая кислота может быть использована для более тщательного изучения этих неуловимых веществ и даже выступать в качестве эффективного катализатора в химической промышленности.
А пока в планах исследователей использовать полученную кислоту для присоединения водорода к атомам инертного газа ксенона. Зачем? Просто это очень заманчивая задача: заставить суперкислоту прореагировать с инертным газом.
Соляная кислота. Свойства соляной кислоты
Раствор хлористого водорода химически вреден, класс его опасности - второй.
Соляная жидкость - это сильная одноосновная кислота, которая может вступать в реакцию с множеством металлов, их солями, оксидами и гидрооксидами, она может взаимодействовать с нитратом серебра, аммиаком, гипохлоритом кальция и сильными окислителями:
- взаимодействие с металлами, с образованием соответствующих хлоридов и выделением водорода
- взаимодействие с солями металлов, образованных слабыми кислотами
- взаимодействие с оксидами металлов с образованием солей и воды
- взаимодействие с гидроксидами металлов с образованием растворимых хлоридов и воды
- взаимодействие с сильными окислителями с выделением хлора
- вступает в реакцию с аммиаком
- реакция с нитратом серебра, в результате образуется осадок хлорида серебра
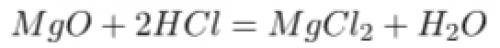
Физические свойства и влияние на организм
При высоких концентрациях это едкое вещество, которое может вызвать ожоги не только слизистых оболочек, но и кожных покровов. Нейтрализовать его можно раствором пищевой соды. При открытии емкостей с концентрированным соляным раствором, его пары, соприкасаясь с находящейся в воздухе влагой, образовывают конденсат ядовитых паров в виде мельчайших капелек (аэрозоля), который раздражает дыхательные пути и глаза.
Концентрированное вещество имеет характерный резкий запах. Технические сорта раствора хлористого водорода делят на:
рыжий неочищенный, его цвет в основном обуславливается примесями хлорного железа;
очищенный, бесцветная жидкость, в которой концентрация HCl составляет порядка 25%;
дымящий, концентрированный, жидкость с концентрацией HCl в 35-38%.

Какая кислота разъедает кожу. ПЕРВАЯ ПОМОЩЬ: ХИМИЧЕСКИЙ ОЖОГ
ХИМИЧЕСКИЕ ОЖОГИ являются результатом воздействия на ткани (кожные покровы, слизистые оболочки) веществ, обладающих выраженным прижигающим свойством (крепкие кислоты, щелочи, соли тяжелых металлов, фосфор). Большинство химических ожогов кожных покровов являются производственными, а химические ожоги слизистой оболочки полости рта, пищевода, желудка чаще бывают бытовыми.
ПОД ДЕЙСТВИЕМ ЕДКИХ ВЕЩЕСТВ КОЖА И СЛИЗИСТЫЕ ОБОЛОЧКИ БЫСТРО ОМЕРТВЕЮТ. Агрессивные химические вещества медленно проникают в ткани, поэтому длительно поражают организм, разрушая эритроциты, нарушая обмен в тканях, функции внутренних органов (общее отравление). С момента соприкосновения этих веществ с покровами тела до завершения химических реакций обычно проходит время. Вследствие этого степень проявления ожога химическим соединением во многом зависит от типа этого вещества, его концентрации, времени воздействия на организм пострадавшего, состояния и индивидуальных особенностей (повышенной чувствительности) человека.
ВАШИ ДЕЙСТВИЯ
· Немедленно вызовите «скорую помощь».
· Быстро снимите одежду, удалите с кожи химическое вещество (сухим тампоном, платком и т.д.). при ожоге кислотой пользоваться влажным тампоном опасно, так как вещество, смешавшись с водой, глубоко проникнет в кожу через поры.
· При ожогах кислотой лейте на поверхность кожи в течение 15-20 минут раствор соды (1 чайная ложка на стакан воды) или холодную мыльную воду. Ожог плавиковой кислотой промывайте проточной водой 2-3 часа.
· Если ожог вызван щелочью, промытые водой участки кожи обработайте раствором лимонной или борной кислоты (половина чайной ложки порошка на стакан воды) либо столовым уксусом, наполовину разбавленным водой.
· Участки тела, пораженные фосфором, погрузите в воду или промойте сильной струей воды (на воздухе фосфор вспыхивает). Обработайте место ожога 5%-ным раствором медного купороса и закройте чистой сухой повязкой. При смазывании зоны ожога жиром, маслом или мазями фосфор всасывается в кожу – ЭТО ОПАСНО!
· Ожог, вызванный негашеной известью, сразу смывать водой нельзя (выделяется тепло и усиливается термическая травма). Удалите известь с кожи куском сухой чистой ткани; затем промойте кожу проточной водой и обработайте любым растительным маслом. Наложите сухую стерильную повязку.
Источник: https://interesnyefakty.com/novosti/sernaya-kislota-rastvoryaet-vse-opredelenie
Плавиковая кислота растворяет человека. Отравление лимонной кислотой
Лимонная кислота считается пищевой добавкой, тем не менее, случаи отравления ею учащаются. Обычно лимонная кислота есть в каждом доме, хранится на видном месте. Ее может взять каждый, может перепутать с другим средством. Часто дети берут лимонную кислоту, оставшись без наблюдения взрослых, употребляют внутрь в больших количествах, что приводит к отравлениям. Также содержится в природе в составе многих фруктов и овощей, в косметических средствах.
Отравление лимонной кислотой можно заподозрить в том случае, если у человека наблюдаются сильные болезненные ощущения в пищеводе, желудке. Все это сопровождается головной болью и головокружением, рвотой. Нарушается работа кишечника, кожа становится бледной, а иногда, наоборот, синеет.
Постепенно состояние ухудшается: учащается сердцебиение, резко снижается давление. Могут развиться судороги. Если на этом этапе не оказать первую помощь, человек может потерять сознание и впасть в кому. Особенность этого вида отравления состоит в том, что симптомы развиваются медленно, постепенно. Поэтому можно своевременно заметить нарушения и обратиться за помощью. До коматозного состояния пациент доходит крайне редко. При химическом ожоге кожи происходит резкое покраснение кожи, раздражение. Все это сопровождается резкой болью.
Первая помощь состоит в том, что больному нужно приложить лед на живот. При этом происходит сужение сосудов и замедляется всасывание яда. Нельзя делать человеку промывание или вызывать рвоту, поскольку лимонная кислота легко растворяется в воде, может вызвать повторный ожог пищевода, начнет быстрее всасываться в кровь, что существенно ухудшит состояние. При попадании на кожу тщательно промывают водой, моют мылом. Больному нужно обеспечить полный покой и как можно быстрее вызвать скорую помощь.
В больнице проводят основное лечение. Больному назначают симптоматическую терапию, адсорбенты, обезболивающие средства. При необходимости проводится промывание желудка. Если есть кровотечение назначают средства, останавливающие кровотечение. При необходимости проводится оперативное вмешательство, переливание крови.
Наиболее опасными осложнениями являются кровотечения, особенно внутренние, нарушение функции почек и печени, болевой шок, остановка дыхания и сердечной деятельности.
Источник: https://interesnyefakty.com/stati/chto-razedaet-steklo-kakaya-kislota-razedaet-steklo
Фтороводородная кислота. Применение плавиковой кислоты
Плавиковая кислота применение , естественно, находит в стекольной промышленности. Реагент используют для химической полировки изделий и освобождения металлических деталей от примесей кварца и керамики.
Поскольку кремний плавиковая кислота плавит, обрабатывать можно и хрусталь, убирая с его поверхности все шероховатости. В качестве протравливающего вещества реагент используют, так же, в зуботехнической отрасли. Плавиковая кислота в стоматологии убирает с внутренней стороны керамических протезов лейцит.
Это породообразующий минерал магматического происхождения. Он – часть металлической подложки под слоем керамики. Цель – обеспечить максимально надежное крепление коронки к остаткам зуба. Лучше стандартного цемента с этой задачей справляются полимеры – новое слово в стоматологии.

Полимеры заполняют пустоты, оставшиеся от лейцита. Таким образом, живые ткани и протез скрепляются, как говориться, намертво. При этом, полимеры оставляют возможность минимальных подвижек, без растрескивания, а значит, и разгерметизации коронок.
Однако, основным потребителем фтороводорода остается нефтехимическая промышленность. В ней плавиковая кислота, так же, нужна для обработки, очистки поверхностей. В частности, соединение пригождается в призабойных зонах добывающих скважин.
В нагнетательных реагент тоже используют. В сочетании с другими кислотами, к примеру, соляной, плавиковая кислота удаляет со стенок аппаратуры отложения асфальтов и парафинов. Это повышает эффективность нефтедобычи.
Кислота фтористоводородная плавиковая применяется и в алюминиевой промышленности. Реагент непосредственно участвует в электролитическом способе получения 13 металла.
Кислота присутствует в фильтровочных системах. Теперь выясним, где найти реагент в природе. Является ли флюорит единственным источником фтороводорода?
Что разъедает щелочь. Что собой представляет
Едкий натр – второе название каустической соды. Химическая формула вещества – NaOH (гидроксид натрия). Считается одной из сильнейших щелочей, способной разъедать органические вещества.
Благодаря этому свойству гидроксид натрия справляется даже с сильными загрязнениями, буквально «съедая» грязь биологического происхождения. Несмотря на то, что кожа человека – органическое вещество, каустик используют в косметологии в качестве основы для мыла. Именно каустическая сода дает мылкость, образует пену.
Отличие от других видов
С химической точки зрения каустик нельзя считать аналогом кальцинированной соды , которая также помогает справиться с загрязнениями, засорами, жирными пятнами в быту. Разница между каустической содой и кальцинированной содой, прежде всего, в происхождении веществ и химическом составе.
Кальцинированная сода – это обезвоженная соль угольной кислоты, карбонат натрия. Дома каустическую соду получают в результате реакции карбоната натрия с водой. Вторым продуктом реакции является гидрокарбонат натрия – пищевая сода. Каустик назван содой условно, так как не относится к солям, не содержит оксид углерода.
В отличие от своих «родственников», гидроксид натрия нельзя считать бытовым чистящим порошком универсального применения. Основные различия с кальцинированной и пищевой содой представлены в таблице.
Щелочь -- это. Значение слова «щёлочь»
ЩЁЛОЧЬ , -и, род. мн. щелоче́й , ж. Хим. Растворимое в воде вещество, образующееся при соединении соли с кислотой. Водный раствор щелочи. Едкие щелочи.
Источник (печатная версия): Словарь русского языка: В 4-х т. / РАН, Ин-т лингвистич. исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.; Полиграфресурсы, 1999; (электронная версия):
ЩЁЛОЧЬ , и, ж. (хим.). Едкое химическое соединение, окрашивающее красную лакмусовую бумагу в синий цвет, образующее в соединении с кислотою соль.
Источник: «Толковый словарь русского языка» под редакцией Д. Н. Ушакова (1935-1940); (электронная версия):
щёлочь
1. хим. растворимое в воде сильное основание , создающее в водном растворе большую концентрацию ионов ОН-; гидроксид какого-либо из щелочных и щёлочно-земельных металлов ◆ Каустическая сода является сильной щёлочью .
Ортофосфорная кислота. Характеристики ортофосфорной кислоты
Услышав слово кислота, человек невольно напрягается, ведь еще из давних уроков химии в школьные годы известно, что кислота может оказывать довольно значимое влияние на предметы или, к примеру, кожу человека. А что собой представляет ортофосфорная кислота? Опасна ли ортофосфорная кислота, применение которой рекомендуется как один из способов борьбы с налетом ржавчины?
Ортофосфорная или попросту фосфорная кислота представляется в виде продукта, имеющего неорганическое происхождение. В условиях нормальной комнатной температуры ортофосфорная кислота имеет вид небольших ромбовидных кристалликов.
Чаще всего же ортофосфорная кислота имеет вид сиропообразного 85%-процентного раствора, не имеющего характерного запаха. Кристаллики ортофосфорной кислоты довольно хорошо растворяются в воде или этаноле.
Уравнение ортофосфорной кислоты
Применяется ортофосфорная кислота в следующих отраслях человеческой деятельности:
- Создание удобрений (фосфатных),
- Производство специальных чистящих средств, относящихся к классу бытовой химии,
- Стоматология,
- Вещества для борьбы с коррозией металла,
- Звероводство,
- Пищевая промышленность.
Если температура окружающей среды, например, в условиях лабораторных исследований превышает показатели в 213 градусов Цельсия, ортофосфорная кислота преобразуется в пирофосфорную кислоту. Состав ортофосфорной кислоты и ее химическая формула, соответственно, изменяется.