Серная кислота растворяет все. Определение
- Серная кислота растворяет все. Определение
- Какая кислота разъедает кожу. Проявления застоя желчи Симптомы холестаза могут отличаться при разных формах заболевания, а в некоторых случаях практически полностью отсутствовать. Заподозрить патологию помогают следующие ее проявления:
- Серная кислота применение. Серная кислота. Свойства, добыча, применение и цена серной кислоты
- Серная кислота реагирует с. Использование H2SO4 в разбавленном виде
- Разбавленная серная кислота не взаимодействует с. Серная кислота
- Соляная кислота и серная кислота реакция. Соляная кислота —, что это такое
Серная кислота растворяет все. Определение
Серная кислота (серная кислота) является едкой минеральной кислотой с маслянистым, стекловидным внешним видом, что дало ей более раннее название масла купороса. Другие названия – сульфиновая кислота, аккумуляторная кислота и сероводород. Формула серной кислоты H2SO4 указывает на присутствие атома серы, окруженного двумя гидроксидными соединениями и двумя атомами кислорода. Эта мощная кислота используется в различных отраслях промышленности, прежде всего в производстве удобрений и химических веществ.
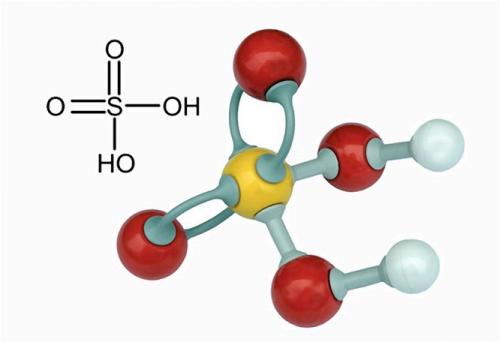

Короче говоря, Производство серной кислоты делится на пять этапов – извлечение серы из земли или в качестве побочного продукта других производственных процессов, превращение серы в диоксид серы, дальнейшее превращение диоксида серы в триоксид серы и окончательное добавление воды для превращения триоксида серы в дымящую серную кислоту и добавление концентрированной серной кислоты для получения еще большего количества молекул.
Серная кислота в производстве удобрений
Производство удобрений использует серную кислоту для добавления серы в почву. Большая часть сельскохозяйственных земель требует источника серы для замены того, что использовалось зерновыми культурами или выщелачивалось в дождливые периоды. Недостаток серы приводит к лист пожелтение, лист и ткань некроз и задержка развития. Пока растения не могут использовать элементарную серу , почвы бактерии окисляют это, чтобы сформировать сульфат. Сульфат является наиболее важным источником питания для всех растение Жизнь и растения могут легко поглотить его через свои корни.
Во время переработки ископаемого топлива сера извлекается в качестве побочного продукта из угля, сырой нефти и природного газа, которые содержат его в небольших или больших количествах. Во время переработки ископаемого топлива эта сера удаляется и чаще всего отправляется в виде серной кислоты на заводы по производству удобрений. Сера не только добавляется в почву, но и необходима для производства суперфосфата извести, где фосфат породы смешивается с серной и фосфорной кислотой. Суперфосфат извести позволяет растениям поглощать фосфаты. Другим важным удобрением является сульфат аммония, получаемый в результате реакции между аммонием и серной кислотой. Серная кислота, производимая для производства удобрений, имеет техническую чистоту или загрязнена и слабо окрашена с концентрацией от 78 до 93%.
Серная кислота в химическом производстве
Использование серной кислоты в химическом производстве включает производство капролактама для нейлоновых волокон и диоксида титана, который представляет собой ярко-белый пигмент. Кроме того, серная кислота необходима для производства плавиковой кислоты, которая заменила хлорфторуглероды (ХФУ) для использования в холодильниках или системах кондиционирования воздуха.
Сульфатные соли, такие как сульфат кальция (гипс и гипс) и гидросульфат, являются производными этой конкретной кислоты. Хотя сульфиты металлов, как правило, нелегко растворяются в воде, другие сульфатные соли, наоборот, образуют серную кислоту один из самых доступных и лучших растворителей для использования в широком спектре отраслей промышленности , Минеральные добавки в секторе здравоохранения и лауретсульфат натрия в шампуне и туалетных принадлежностях являются другими примерами сульфатных солей. Именно эти частицы способствуют кислотному дождю, но в то же время они могут играть незначительную защитную роль в качестве частиц в воздухе по отношению к диффузия солнечной радиации.
Серная кислота также используется для производства взрывчатых веществ. Добавление азотной и серной кислот в целлюлозу делает легковоспламеняющейся нитроцеллюлозой. По этой причине покупка серной кислоты в больших количествах требует лицензии. Коммерческая серная кислота продается с минимальной концентрацией 95%.
Какая кислота разъедает кожу. Проявления застоя желчи Симптомы холестаза могут отличаться при разных формах заболевания, а в некоторых случаях практически полностью отсутствовать. Заподозрить патологию помогают следующие ее проявления:
- Кожный зуд. Симптом усиливается вечером и после соприкосновения кожи с теплой водой. Это провоцирует появление на коже расчесов, гнойничковой сыпи. Пациент становится тревожным, раздражительным, страдает бессонницей.
- Чувство распирания и боль в подреберье с правой стороны. Последняя может «отдавать» в правую лопатку, руку, ключицу, поясничную область.
- Изменение цвета кожи и слизистых. Обычно это проявляется в виде желтизны склер глаз, затем желтушность распространяется и на другие части тела. Также может наблюдаться гиперпигментация – потемнение кожных покровов.
- Нарушение стула. Для холестаза характерен обесцвеченный желтый, серый или белый кал. Из-за обилия жиров он становится жидким, имеет зловонный запах. Позже присоединяются нарушение пищеварения и запоры.
- Образования на коже. На груди, спине, локтях можно увидеть ксантомы (утолщенные участки огрубевшей кожи на теле коричневого или желтого цвета). Симметричные образования на веках желтого цвета называются ксантелазмами. Они появляются при росте количества холестерина в крови в течение трех и более месяцев и могут исчезать после его нормализации.
- Диспепсические расстройства. Во рту присутствует горький привкус, отмечаются тошнота и рвота. Аппетит часто снижен или отсутствует, из-за чего пациент теряет вес.
- Потемнение мочи. Выделяемая жидкость из соломенно-желтой становится цвета «темного пива».
- Признаки гиповитаминоза (из-за нарушения усвоения жиров нарушается усвоение жирорастворимых витаминов — А, Д, Е, К). Витамин К при затяжном холестазе недостаточно всасывается из кишечника, и появляется повышенная кровоточивость. Дефицит витамина D сопровождается хрупкостью костей и болевыми ощущениями в конечностях и спине. При плохом всасывании витамина А ухудшается зрение вдаль, и человек хуже видит в темноте. Дефицит витамина Е снижает либидо.
Серная кислота применение. Серная кислота. Свойства, добыча, применение и цена серной кислоты
В городе Ревда с рельсов сошли 15 вагонов с серной кислотой. Груз принадлежал Среднеуральскому медеплавильному заводу.
ЧП произошло на ведомственных железнодорожных путях в 2013-ом году. Кислота разлилась на площади в 1000 квадратных километров.
Это указывает на масштабы потребности промышленников в реагенте. В Средние века, к примеру, в год требовались лишь десятки литров серной кислоты.
В 21-ом же веке мировая выработка вещества в год – десятки миллионов тонн. По объему производства и применения судят о развитии химических отраслей стран. Так что, реагент достоин внимания. Описание начнем со свойств вещества.
Свойства серной кислоты
Внешне 100-процентная серная кислота – маслянистая жидкость. Она бесцветна и тяжела, отличается крайней гигроскопичностью.
Это значит, что вещество поглощает из атмосферы пары воды. При этом, кислота выделяет тепло.
Поэтому, к концентрированной форме вещества воду добавляют малыми дозами. Влей много и быстро, полетят брызги кислоты.
Учитывая ее свойство разъедать материи, в том числе, и живые ткани, ситуация опасна.
Концентрированной серной кислотой называют раствор, в котором реагента больше 40%. Такой способен растворить серебро , палладий .
Раствор серной кислоты до 40% — неконцентрированный, химически проявляет себя иначе. Воду в него доливать можно достаточно быстро.
Палладий с серебром не растворятся, зато, распадутся железо , латунь и медь . А вот концентрату кислоты все три металла не подвластны.
Если смотреть на таблицу Менделеева , серная кислота в растворе реагирует с активными металлами, стоящими до водорода.

Насыщенное же вещество взаимодействует и с неактивными. Исключение – благородные металлы. Почему же концентрат не «трогает» железо, медь?
Причина в их пассивации. Так называют процесс покрытия металлов защитной пленкой оксидов.
Она-то и препятствует растворению поверхностей, правда, лишь в обычных условиях. При нагреве реакция возможна.
Разбавленная серная кислота больше похожа на воду, нежели масло. Концентрат же, отличим не только по тягучести и плотности, но и дыму, исходящему от вещества на воздухе.
К сожалению, в Мертвом озере на Сицилии содержание кислоты меньше 40%. По внешнему виду водоема не скажешь, что он опасен.
Однако, из дна сочится опасный реагент, образующийся в породах земной коры. Сырьем может служить, к примеру, пирит .
Этот минерал еще зовут серным колчеданом . При контакте с воздухом и водой распадается на 2-ух и 3-ех валентное железо.
Второй продукт реакции – серная кислота. Формула героини статьи , соответственно: — H2SO3. Нет ни специфического цвета, ни запаха.
Опустив, по незнанию, руку в воды сицилийского озера Смерти на пару минут, люди лишаются кожи .
Учитывая разъедающую способность водоема, местные преступники взялись сбрасывать в него трупы. Несколько дней, и от органики не остается и следа.
Продуктом реакции серной кислоты с органикой нередко является уголь . Реагент отщепляет от органики воду. Вот и остается черный углерод.
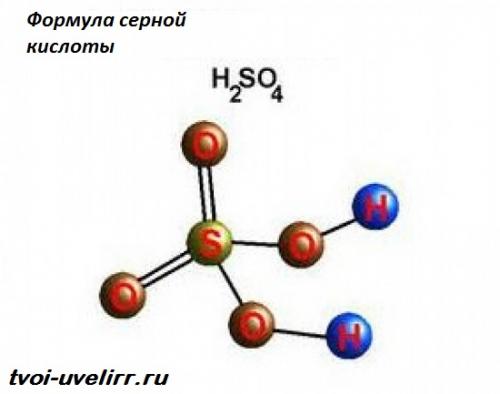
В итоге, топливо можно получить из «сырой» древесины, сахара . Человеческие ткани – не исключение. Но, это уже сюжет для фильма ужасов.
Качество горючего получаемого из обработанной органики низкое. Кислота в реакции является окислителем, хотя, может быть и восстановителем.
В последней роли вещество выступает, к примеру, взаимодействуя с галогенами. Это элементы 17-ой группы таблицы Менделеева.
Все эти вещества сами не являются сильными восстановителями. Если же кислота встречается с таковыми, выступает лишь в роли окислителя.
Пример: — реакция с сероводородом. А какие реакции дают саму серную кислоту, как ее добывают и производят?
Добыча серной кислоты
В прошлые века реагент добывали не только из железной руды, называемой пиритом, но и из железного купороса, а так же, квасцов.
Под последним понятием скрываются кристаллогидраты сульфатов, двойные соли .
В принципе, все перечисленные минералы являются серосодержащим сырьем, поэтому, могут применяться для производства серной кислоты и в современности.
Минеральная основа бывает разной, но итог ее обработки один – серный ангидрит с формулой SO2. Образуется при реакции серы с кислородом. Получается, нужно сжечь основу.
Полученный ангидрит проходит абсорбцию водой. Формула реакции такова: SO2+1/2O2+H2) -àH2SO4. Как видно, в процессе участвует кислород.
В обычных условиях сернистый ангидрид с ним взаимодействует медленно. Поэтому, промышленники окисляют сырье на катализаторах.

Метод именуется контактным. Есть еще нитрозный подход. Это окисление оксидами азота .
Однако, за последний метод «голосуют» лишь 20% промышленников. Основная же масса серной кислоты получается по контактной схеме.
Если подсчитать практику человечества по получению серной кислоты, «накапает» более 1000 лет.
Серная кислота реагирует с. Использование H2SO4 в разбавленном виде
Серная кислота имеет одну особенность — она может отнимать воду, из-за чего её часто используют как надёжное гигроскопическое средство во многих химических реакциях. С помощью этой жидкости можно получать органические вещества, провести осушку, а также снизить вероятность поглощения воды конкретными элементами. Для решения всех этих задач в лабораторных условиях используются специальные герметические ёмкости, которые называются эксикаторами.
Востребованность H2SO4 никогда не уменьшается, так как она имеет широкую сферу применения. Концентрированная жидкость может обугливать органические вещества (например, древесину), а также вызывать сильные ожоги кожного покрова. Если для проведения химических экспериментов нужно использовать кислоту, тогда должны быть соблюдены все правила безопасности. Если капля разбавленной жидкости H2SO4 попала на кожу либо одежду, то по мере испарения воды она постепенно будет увеличивать свою концентрацию.

Разбавленная кислота может вступать в реакцию замещения, что спровоцировано окислением катионов. По этой причине на все активные металлы, которые находятся до водорода в ряду напряжений, H2SO4 реагирует как обычная кислота. Постепенно происходит вытеснение водорода. Этот эффект подробно объясняют на уроках химии в 8 классе. С разбавленной серной кислотой не взаимодействуют благородные металлы (например, золото, платина) и те элементы, которые стоят после водорода в ряду напряжения. Другими окислительными свойствами разбавленная маслянистая жидкость H2SO4 не обладает.
Лабораторные исследования подтвердили, что кислота реагирует на основные оксиды и основания, из-за чего образуется сразу 2 ряда солей: кислые — гидросульфаты, средние — сульфаты. К качественным реакциям на H2SO4 можно отнести взаимодействие с солями бария, в результате чего образуется белый осадок, который не растворяется в воде и кислой среде. Эту химическую реакцию можно изобразить с помощью формулы: H2SO4 + BaCl 2 = BaSO 4↓ + 2HCl.
Разбавленная серная кислота не взаимодействует с. Серная кислота
– это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
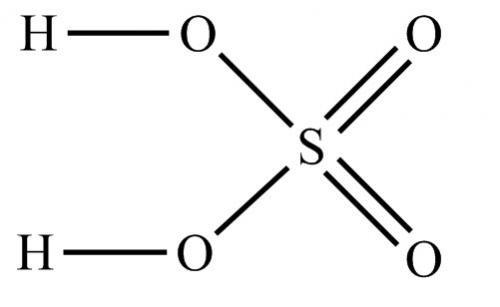
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
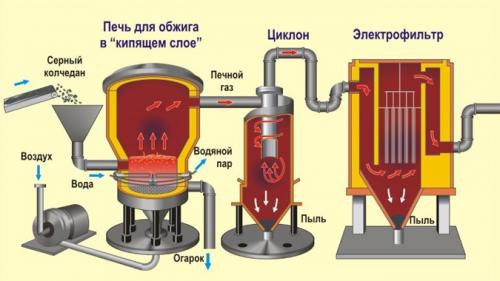
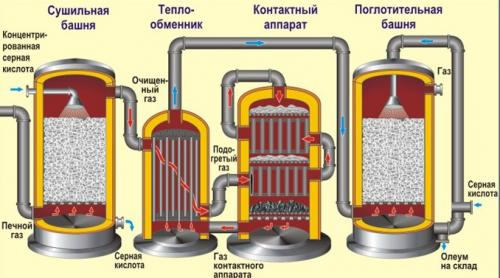
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2+ 11O2 → 2Fe2O3+ 8SO2+ Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800оС |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2+ O2↔ 2SO3+ Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2в SO3. Образовавшийся оксид серы SO3выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. nSO3+ H2SO4 → H2SO4·nSO 3 Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Соляная кислота и серная кислота реакция. Соляная кислота —, что это такое
ОпределениеСоляная кислота (хлороводородная или хлористоводородная кислота) HCl — является раствором хлороводорода в воде, представляет собой сильную одноосновную кислоту.
Соляная кислота не имеет окраски, является прозрачной и едкой жидкостью, которая обладает способностью «дымить» в воздушной среде. По причине наличия примесей железа, растворенного хлора и прочих веществ для технической соляной кислоты характерен желтоватый оттенок. В концентрации около 0,5 % соляная кислота содержится в желудке человека. Соли соляной кислоты называют хлоридами.