Факты о натрии. Натрий — интересные факты
- Факты о натрии. Натрий — интересные факты
- Интересные факты о хлориде натрия. Хлорид натрия — важнейший химический реактив
- Щелочные металлы интересные факты. Щелочные металлы
- Интересные факты о гидроксидах. Едкие щелочи
- Интересные факты про калий. Быстрые факты: калий
- Натрий. История и происхождение названия
Факты о натрии. Натрий — интересные факты
Этот химический элемент представляет собой мягкий щелочной металл серебристого цвета. Он легко окисляется на воздухе, образуя оксид натрия. При горении же превращается в пероксид. В промышленности его используют как сильный восстановитель. Иногда натрий применят для создания электрических проводов. Представляем интересные факты о натрии.
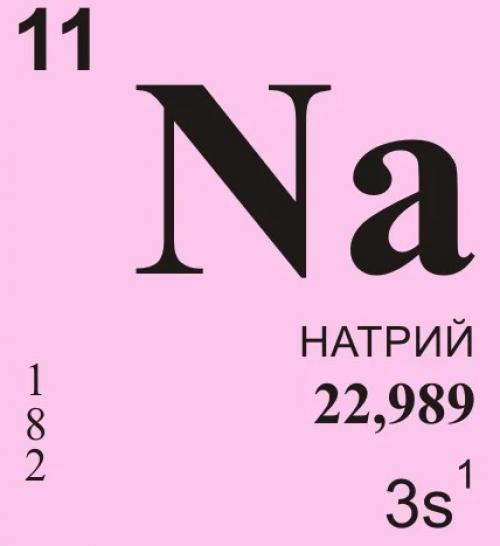
Этот элемент является весьма интересным не только для учёных, но и для людей, которые плохо разбираются в химии. Далее будут перечислены несколько фактов об одном из сильнейших восстановителей на планете Земля:
- Если взять металлический натрий в руку, то элемент большой вероятностью самовоспламеняться или взорвётся. Это явление связано с тем, что кожа человека выделяет жидкость (пот), которая бурно реагирует с металлом.
- Натрий присутствует практически во всех живых организмах и продуктах питания.
- Сплав натрия и калия является одним из лучших жидкометаллических теплоносителей, используемых в атомной энергетике.
- Чтобы этот щелочной металл не окислялся на воздухе его перевозят и хранят в сосудах под слоем керосина.
- Хлорид натрия в средние века люди называли «белым золотом» из-за очень большой цены. Подобная ситуация сложилась и в начале девятнадцатого века, когда соль была почти в 4 раза дороже говядины.
- Натрий при повышении давления способен становиться прозрачным и красным.
- В самом начале натрий именовался не как natrium, а как sodium. Это объясняется применением в последней трети восемнадцатого века натрия для лечения головной боли.
- Химический элемент нашёл своё применение при получении органических полимеров в качестве катализатора.
- В металлургии весьма выгодно получать тугоплавкие металлы из их соединений с помощью натрия.
- Гидроксид этого металла используется в основном для очистки продуктов переработки нефти.
- Натрию свойственна высокая химическая активность, из-за которой его невозможно найти в чистом виде на планете Земля.
- У химического элемента лишь один стабильный изотоп23Na. Остальные (от18Na по22Na и от24Na по37Na) распадаются с выделением энергии. Самый большой период полураспада имеет22Na и составляет 2,6027 года, самый маленький — 1,3*1023сек. у18Na.
- В организмах живых существ металл поддерживает кислотно-щелочной баланс, нормализует водный и другое.
- За день человеческие почки способны переработать без угрозы для жизни 20-30 натриевой граммов соли.
Интересные факты о хлориде натрия. Хлорид натрия — важнейший химический реактив
Хлорид натрия составляет основу поваренной соли, самой популярной приправы к пище. Кроме этого, натриевая соль соляной кислоты миллионами тонн потребляется промышленностью для различных целей.
к пище. Кроме этого, натриевая соль соляной кислоты миллионами тонн потребляется промышленностью для различных целей.
Свойства хлорида натрия
NaCl представляет собой кристаллы с кубической ионной решеткой. Кристаллы без цвета и запаха, с четко выраженным соленым вкусом. Хлористый натрий водорастворим, не гигроскопичен. Растворяется в аммиаке, этиловом и метиловом спирте, муравьиной кислоте, глицерине, этиленгликоле. Не растворяется в ацетоне, соляной кислоте, диэтиловом эфире.
Водный раствор хлорида натрия замерзает при температуре ниже нуля. Благодаря этому свойству химреактив довольно долго использовался в качестве антигололедного средства на дорогах и тротуарах (сейчас этот способ считается экологически вредным и применяется все реже). На этом же свойстве основано применение смеси мелко наколотого льда и поваренной соли в качестве эффективного и простого охладителя, способного понизить температуру смеси на пару десятков градусов.
Хлорид натрия в природе и жизни человека
 NaCl очень важен для человека: он необходим нам для усвоения питательных веществ в процессе пищеварения; наша кровь в немалой степени состоит из солевого раствора; хлорид натрия входит в число важнейших источников минерального сырья для химической промышленности.
NaCl очень важен для человека: он необходим нам для усвоения питательных веществ в процессе пищеварения; наша кровь в немалой степени состоит из солевого раствора; хлорид натрия входит в число важнейших источников минерального сырья для химической промышленности.
В природе хлористый натрий встречается в морской воде, соленых озерах, в соляных подземных водах, в ископаемом виде (галит, каменная соль). Галит — это минеральная форма NaCl. Иногда галит называют каменной солью, но это неверно. Каменная соль — это осадочная порода, содержащая 90% галита и примеси железа, гипса, магнезита, талька, битумов, соединений калия, кальция, магния, йода, брома, бора. Каждое месторождение каменной соли имеет свой уникальный состав.
Морская соль, получаемая выпариванием морской воды, содержит больше жизненно важных для человека примесей химических элементов, минералов и солей, чем каменная соль. В ней только 77,8% хлористого натрия. Она имеет горьковатый вкус, используется, преимущественно, в медицине и кулинарии.
Применение NaCl
— Химреактив применяется для производства более полутора тысяч веществ и материалов, начиная от металлического натрия и хлора и кончая содой, соляной кислотой, гидроксидом натрия, гербицидами для сельского хозяйства.
— Поваренная соль — готовый продукт, на 97 и более процентов состоящий из NaCl, используется в пищевой промышленности. Чем выше содержание хлорида натрия, тем выше сорт соли. Выпускаются также специализированные сорта с добавками микроэлементов, например, иодированная соль. Пищевая соль применяется как приправа в пищу, в качестве консерванта.
— В промышленной и полупромышленной водоподготовке для регенерации ионообменных смол в натрий-катионитовых фильтрах.
— Растворы хлорида натрия востребованы в медицине для приготовления и разведения лекарственных средств, для восстановления водно-солевого баланса организма, при кровотечениях, в качестве антидота при отравлении нитратом серебра, как антибактериальное средство для обработки ран, для некоторых других целей.
— В зоологии — для добавки в рацион животных.
Магазин «ПраймКемикалсГрупп» предлагает по хорошей цене купить поваренную соль оптом и в розницу. Также у нас широко представлены другие реактивы для лабораторных исследований и промышленности, лабораторная посуда и приборы.
Щелочные металлы интересные факты. Щелочные металлы
- Цезий и рубидий используются в фотоэлементах, топливных элементах.
- Цезий применяется в источниках тока, энергоемких аккумуляторах, счетчиках радиоактивных частиц, гамма-спектрометрах для космических аппаратов; приборах ночного видения и оружейных прицелах. Изотопы цезия используются для стерилизации пищевой тары, медицинских инструментов, мясных продуктов, лекарств; они входят в состав некоторых лекарств, применяются для радиотерапии опухолей.
- Рубидий входит в состав болеутоляющих, снотворных, успокаивающих препаратов. Применяется в телевизионных трубках, оптических приборах, низкотемпературных источниках тока, в смазке для космических аппаратов, высокочувствительных магнитометрах для космических и геофизических исследований. Производные рубидия используются в атомной промышленности, химпроме, вакуумных радиолампах, высокотемпературных термометрах.
- Калий и натрий применяются в воздухо-восстановительных системах на подводных лодках и батискафах, в автономных противогазах и дыхательных аппаратах.
- Литий востребован в источниках тока, для производства подшипниковых сплавов и литийорганических соединений, как катализатор в химпроме.
- Натрий применяется в газоразрядных лампах, в металлургии; как теплоноситель в атомной индустрии; в химической индустрии в процессах орг.синтеза.
- В разных сферах промышленности и быта используется большое количество производных щелочных металлов, например, пищевая и кальцинированная сода, поваренная соль, натриевая и калийная селитра , нитраты, сульфаты, карбонаты, гидроксиды натрия, калия и лития и пр.
Щелочные металлы — группа неорганических веществ, простых элементовтаблицы Менделеева. Все они обладают похожим атомным строением и соответственно, похожими свойствами. В группу входят калий, натрий, литий, цезий, рубидий, франций и теоретически описанный, но еще не синтезированный элемент унуне́нний. Первые пять веществ существуют в природе, франций — искусственно созданный, радиоактивный элемент. Свое название щелочные металлы получили из-за способности образовывать щелочи в реакции с водой.
Вся элементы группы химически активны, поэтому на Земле встречаются только в составе различных минералов, например, каменной, калийной, поваренной соли, буры, полевого шпата, морской воды, подземных рассолов, чилийской селитры . Франций часто сопутствует урановым рудам; рубидий и цезий — минералам с натрием и калием.
Свойства
Все представители группы — мягкие металлы, их можно резать ножом, сгибать руками. Внешне — блестящие, белого цвета (кроме цезия). Цезий отливает золотистым блеском. Легкие: натрий и калий легче воды, литий всплывает даже в керосине. Классические металлы с хорошей электро- и теплопроводностью. Горят, придают пламени характерный цвет, являющийся одним из аналитических способов определить тип металла. Легкоплавкие, самым «тугоплавким» является литий (+180,5 °С). Цезий тает прямо в руках при температуре +28,4 °С.
Активность в группе увеличивается по мере роста атомной массы: Li →Cs. Обладают восстановительными свойствами, в том числе в реакции с водородом. Проявляют валентность -1. Бурно реагируют с водой (все кроме лития — со взрывом); с кислотами, кислородом. Взаимодействуют с неметаллами, спиртами, водным аммиаком и его производными, карбоновыми кислотами, многими металлами.
Калий и натрий являются биогенными элементами, участвуют в водно-солевом и кислотно-щелочном балансе человеческого организма, необходимы для нормальной циркуляции крови и функционирования многих энзимов. Калий важен для растений.
В нашем организме есть и рубидий. Его нашли в крови, костях, головном мозге, легких. Он оказывает противовоспалительное, противоаллергическое действие, притормаживает реакции нервной системы, усиливает иммунитет, положительно влияет на состав крови.
Меры предосторожности
Щелочные металлы очень опасны, способны воспламеняться и взрываться просто от контакта с водой или воздухом. Многие реакции протекают бурно, поэтому работать с ними допускается только после тщательного инструктажа, с применением всех мер предосторожностей, в защитной маске и защитных очках.
Растворы калия, натрия и лития в воде являются сильными щелочами ( гидроксиды калия , натрия, лития); контакт с кожей приводит к глубоким болезненным ожогам. Попадание щелочей, даже низкой концентрации, в глаза может привести к слепоте. Реакции с кислотами, аммиаком, спиртами проходят с выделением пожаро- и взрывоопасного водорода.
Щелочные металлы хранят под слоем керосина или вазелина в герметичных емкостях. Манипуляции с чистыми реактивами проводят в аргоновой атмосфере.
Следует тщательно следить за утилизацией остатков после опытов со щелочными металлами. Все остатки металлов предварительно должны быть нейтрализованы.
Применение
Интересные факты о гидроксидах. Едкие щелочи
А конкретно — гидроксиды щелочных металлов: лития, натрия, калия, рубидия, цезия, франция, гидроксид таллия (I) и гидроксид бария. Но:
- Литий, цезий, рубидий и барий отбрасываем — дорого и редко встретишь
- Если ты, %username%, встретишь гидроксид франция, то едкость тебя будет волновать в последнюю очередь — он жутко радиоактивный
- То же и с таллием — он ядовит до жути.
Гидроксид тетраметиламмония
На самом деле в этих веществах объединились свойства катионных поверхностно-активных веществ (ну это как обычное мыло — только катионное: тут активная дифильная частица — с зарядом "+", а в мыле — с зарядом "-") и относительно высокая основность. Если попадёт на руки — можно намылить в воде и помыть, как мылом, если в водном растворе погреть волосы, кожу или ногти — растворятся. «Едкость» на фоне гидроксидов натрия и калия — так себе.Интересные факты про калий. Быстрые факты: калий
- Название элемента: калий
- Символ элемента: K
- Атомный номер: 19
- Атомный вес: 39,0983
- Классификация: щелочной металл
- Внешний вид: Калий представляет собой твердый серебристо-серый металл при комнатной температуре.
- Конфигурация электронов: Ar 4s1
- Калий - это элемент № 19. Это означает, что атомный номер калия равен 19 или каждый атом калия имеет 19 протонов.
- Калий является одним из щелочных металлов, что означает, что он является высокореактивным металлом с валентностью 1.
- Из-за его высокой реакционной способности калий не найден свободным в природе. Он образуется сверхновыми через R-процесс и происходит на Земле, растворенной в морской воде и в ионных солях.
- Чистый калий - это легкий серебристый металл, достаточно мягкий, чтобы резать ножом. Хотя металл выглядит серебристым, когда он свежий, он тускнеет так быстро, что обычно кажется тускло-серым.
- Чистый калий обычно хранится в масле или керосине, потому что он так легко окисляется на воздухе и реагирует в воде с выделением водорода, который может воспламениться от тепла реакции.
- Ион калия важен для всех живых клеток. Животные используют ионы натрия и ионы калия для генерации электрических потенциалов. Это жизненно важно для многих клеточных процессов и является основой для проведения нервных импульсов и стабилизации кровяного давления. Когда в организме недостаточно калия, может возникнуть потенциально смертельное состояние, называемое гипокалиемией. Симптомы гипокалиемии включают мышечные спазмы и нерегулярное сердцебиение. Переизбыток калия вызывает гиперкалиемию, которая вызывает аналогичные симптомы.Растения требуют калия для многих процессов, поэтому этот элемент является питательным веществом, которое легко истощается сельскохозяйственными культурами и должно пополняться удобрениями.
Натрий. История и происхождение названия
Соединения натрия известны и использовались с давних времён. В древнегреческом переводе Библии — Септуагинте — упоминается слово νίτρον (в латинском переводе — Вульгате — ему соответствует слово nitroet ) как название вещества типа соды или поташа , которое в смеси с маслом служило моющим средством( Иер. ). В Танахе слову νίτρον соответствуют др.-евр. ברית — «мыло» и נתר — «щёлок»(мыльная жидкость). Сода (натрон) встречается в природе в водах натронных озёр в Египте . Природную соду древние египтяне использовали для бальзамирования, отбеливания холста, при варке пищи, изготовлении красок и глазурей . Плиний Старший пишет, что в дельте Нила соду (в ней была достаточная доля примесей) выделяли из речной воды. Она поступала в продажу в виде крупных кусков, из-за примеси угля окрашенных в серый или даже чёрный цвет.
Аббревиатура «Na» и слово natrium были впервые использованы академиком, основателем шведского общества врачей Йёнсом Якобсом Берцелиусом (Jöns Jakob Berzelius, 1779—1848) для обозначения природных минеральных солей, в состав которых входила сода. Ранее (а также до сих пор в английском, французском и ряде других языков) элемент именовался содий ( лат. sodium ) — это название sodium , возможно, восходит к арабскому слову suda , означающему «головная боль», так как сода применялась в то время в качестве лекарства от головной боли.
Металлический натрий впервые был получен английским химиком Хемфри Дэви электролизом расплава гидроксида натрия . Дэви сообщил об этом 19 ноября 1807 года в Бейкеровской лекции (в рукописи лекции Дэви указал, что он открыл калий 6 октября 1807 года, а натрий — через несколько дней после калия).