Натрий интересные факты. Натрий — интересные факты
Натрий интересные факты. Натрий — интересные факты
Этот химический элемент представляет собой мягкий щелочной металл серебристого цвета. Он легко окисляется на воздухе, образуя оксид натрия. При горении же превращается в пероксид. В промышленности его используют как сильный восстановитель. Иногда натрий применят для создания электрических проводов. Представляем интересные факты о натрии.
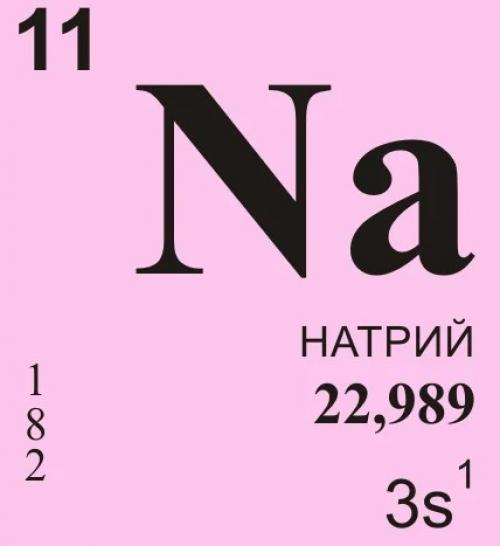
Этот элемент является весьма интересным не только для учёных, но и для людей, которые плохо разбираются в химии. Далее будут перечислены несколько фактов об одном из сильнейших восстановителей на планете Земля:
- Если взять металлический натрий в руку, то элемент большой вероятностью самовоспламеняться или взорвётся. Это явление связано с тем, что кожа человека выделяет жидкость (пот), которая бурно реагирует с металлом.
- Натрий присутствует практически во всех живых организмах и продуктах питания.
- Сплав натрия и калия является одним из лучших жидкометаллических теплоносителей, используемых в атомной энергетике.
- Чтобы этот щелочной металл не окислялся на воздухе его перевозят и хранят в сосудах под слоем керосина.
- Хлорид натрия в средние века люди называли «белым золотом» из-за очень большой цены. Подобная ситуация сложилась и в начале девятнадцатого века, когда соль была почти в 4 раза дороже говядины.
- Натрий при повышении давления способен становиться прозрачным и красным.
- В самом начале натрий именовался не как natrium, а как sodium. Это объясняется применением в последней трети восемнадцатого века натрия для лечения головной боли.
- Химический элемент нашёл своё применение при получении органических полимеров в качестве катализатора.
- В металлургии весьма выгодно получать тугоплавкие металлы из их соединений с помощью натрия.
- Гидроксид этого металла используется в основном для очистки продуктов переработки нефти.
- Натрию свойственна высокая химическая активность, из-за которой его невозможно найти в чистом виде на планете Земля.
- У химического элемента лишь один стабильный изотоп23Na. Остальные (от18Na по22Na и от24Na по37Na) распадаются с выделением энергии. Самый большой период полураспада имеет22Na и составляет 2,6027 года, самый маленький — 1,3*1023сек. у18Na.
- В организмах живых существ металл поддерживает кислотно-щелочной баланс, нормализует водный и другое.
- За день человеческие почки способны переработать без угрозы для жизни 20-30 натриевой граммов соли.
Натрий и калий 2019
Натрий против калия
Натрий и калий являются щелочными металлами, встречающимися естественно вместе с минералами. Оба показывают сходное поведение, включая физические и химические свойства. Они играют решающую роль в поддержании всех форм жизни. Они имеют сходную атомную структуру; их внешняя орбита имеет только один электрон; они являются высокореактивными и образуют ионные связи. Это мягкие металлы, серебристо-белые по внешнему виду с низкой температурой плавления.
натрий Натрий присутствует естественным образом в огромных количествах, растворенных в морской воде. Другие природные отложения этого элемента включают криолит, нитрат соды и цеолит. Натрий представлен как Na, а атомное число Na равно 11. Оно имеет электронную конфигурацию 3s1. Его внешняя орбита имеет только один электрон, и именно поэтому этот металл очень реактивен. Валентность натрия равна 1. Атом теряет свой внешний электрон, легко образуя сильные электровалентные связи. При нагревании этот металл придает пламени характерный цвет. Цвет пламени является результатом возбуждения электронов до более высоких уровней. Это возбуждение вызвано тепловой энергией, передаваемой металлу пламенем. Когда эти возбужденные электроны возвращаются к своим нормальным состояниям, они высвобождают ранее поглощенную энергию в виде видимого света.
Натрий вносит вклад в многие коммерчески важные химические вещества, которые используются для различных промышленных целей. Наиболее часто применяемыми химическими соединениями натрия являются гидроксид натрия, пищевая сода, обычная соль, нитрат натрия, бура и кальцинированная сода. Натрий также играет важную роль во всех жизненных формах. Он поддерживает соответствующий баланс жидкостей в клетках и помогает в передаче нервных импульсов.
калий Калий присутствует на земной коре в виде минералов. Основными рудами, имеющими достаточное количество калия, являются ортоклаз, гранит, сильвит, карналлит. Калий представлен как символ К. Его атомное число равно 19 и имеет электронную конфигурацию 4s1. Калий обладает многими физическими и химическими свойствами, подобными свойствам натрия. Калий также обладает высокой реакционной способностью и образует электровалентные связи. Однако его реакционная способность с водой значительно более жесткая по сравнению с реакцией натрия. Калий также горит в горелке Бунзена, придавая фиолетовое пламя. Несмотря на то, что атомный номер калия больше натрия, плотность калия меньше, чем у натрия. Калий также имеет множество промышленных применений. Он используется при приготовлении коммерческих мыл. Тем не менее, его использование не может превышать коммерческое использование натрия. Калий вместе с натрием образует натрий-калийный насос, который активно транспортирует АТФ в клетки и из них.
Резюме:
1. Натрий представлен как Na, а калий представлен как K. 2. Атомное число натрия равно 11, а у калия - 19. 3. Плотность натрия больше, чем плотность калия. 4. Ожоги натрия в пламени Бунзена, придающие золотисто-желтый цвет, в то время как калий горит бледным фиолетовым пламенем. 5. Взаимодействовать с водой, производящей водородный газ, но реакция калия гораздо более агрессивна по сравнению с реакцией натрия. 6. С кислородом натрий образует пероксид, тогда как калий образует супероксиды.
Соединения натрия
На уроке идет повторение общей характеристики щелочных металлов, знакомство со свойствами и практической ролью соединений натрия.
Описание разработки
Цель урока: обобщить знания о натрии и его важнейших соединениях, доказать высокую химическую активность натрия как щелочного металла.
Задачи урока:
-формировать знания учащихся о важных соединениях натрия, их свойствах и применении;
-развивать логическое мышление, умение в написании химических уравнений реакций;
-воспитание бережного отношения к своему здоровью.
Оборудование: пачка соли, соды, раствор хлорида натрия 0,9%-физиологический раствор, натриева селитра, морская соль.
Тип урока: комбинированный
Методы и приемы: словесный, наглядно-демонстрационный, проблемно-поисковый.
Ход урока
I. Орг. момент /сообщение темы и задач урока/
Тема сегодняшнего урока: "Соединения натрия». Мы повторим общую характеристику щелочных металлов, узнаем о свойствах и практической роли соединений натрия. Но прежде чем приступить к изучению новой темы повторим материал прошлого урока.
Вопросы про натрий. Натрий
На́трий — элемент главной подгруппы первой группы, третьего периода периодической системы химических элементов , с атомным номером 11. Обозначается символом Na (лат. Natrium). Простое вещество натрий (CAS-номер: 7440-23-5) — мягкий щелочной металл серебристо-белого цвета.
История и происхождение названия
Натрий (а точнее, его соединения) использовался с давних времён. Например, сода (натрон), встречается в природе в водах натронных озёр в Египте. Природную соду древние египтяне использовали для бальзамирования, отбеливания холста, при варке пищи, изготовлении красок и глазурей. Плиний Старший пишет, что в дельте Нила соду (в ней была достаточная доля примесей) выделяли из речной воды. Она поступала в продажу в виде крупных кусков, из-за примеси угля окрашенных в серый или даже чёрный цвет. Название «натрий» происходит от латинского слова natrium (ср. др.-греч. νίτρον), которое было заимствовано из среднеегипетского языка (nṯr), где оно означало среди прочего: «сода», «едкий натр». Аббревиатура «Na» и слово natrium были впервые использованы академиком, основателем шведского общества врачей Йенсом Якобсом Берцелиусом (Jöns Jakob Berzelius, 1779—1848) для обозначения природных минеральных солей, в состав которых входила сода. Ранее элемент именовался содием (лат. sodium). Название sodium, возможно, восходит к арабскому слову suda, означающему «головная боль», так как сода применялась в то время в качестве лекарства от головной боли. Натрий впервые был получен английским химиком Хемфри Дэви в 1807 году электролизом твердого NaOH.
Интересные факты о магнии! Магний для здоровья и похудения

Магний является одним из наиболее важных для организма природных минералов. В нашем организме он выполняет более трехсот функций. Магний отвечает за функцию мышц и нервов, нормализует кровяное давление, контролирует сахар в крови, а также необходим для здоровой ДНК и достаточного количества антиоксидантов в организме. Магний играет важную роль при снижении веса. Он просто необходим для стройности фигуры.
Магний влияет на уровень сахара
Одним из лучших эффектов магния является воздействие на уровень сахара. Если вам знакомо чувство тревоги при падении сахара в крови, тогда у вас дефицит магния в организме. Даже если вы едите продукты, богатые магнием, вам этого может не хватать. Организм действительно быстро расходует магний, особенно в период стресса. Диета, богатая магнием, или 400 мг пищевых добавок могут решить эту проблему. Магний поможет снизить уровень инсулина и уменьшит отложение жира.
Влияние магния на нервную систему
Магний действует и на нервную систему. Он помогает уменьшить напряженность, которая приводит к увеличению веса. Во время стресса в организме вырабатывается кортизол. Этот гормон стресса влияет на отложение жира. Магний снимает стресс и помогает избавиться от бессонницы. Попробуйте смешать стакан миндального молока с какао и вы получите напиток, богатый магнием и кальцием.
Магний и артериальное давление
Воздействуя на нервную систему, магний влияет на артериальное давление. Всякий раз при высоком давлении ваш организм напрягается и начинает откладывать жировые запасы. Это серьезная угроза для сердца. А помочь может магний в рационе питания и в виде добавок. Держите под рукой греческий йогурт с куском темного шоколада. Оба продукта богаты магнием и мгновенно снимают стресс.
Помощь после нагрузок
Магний способствует синтезу белка в организме, поэтому при его нехватке ваши мышцы не будут идеальными. После тренировки необходимо организму доставить 400 мг магния. Или побаловать себя продуктами, богатыми этим веществом, такими как хлеб из цельного зерна, орехи и семечки, какао, ростки пшеницы, молочные продукты, рыба, бананы.

Магний и пищеварение
У большинства людей, страдающих от запоров, не только дефицит клетчатки, но и магния. Клетчатку можно легко найти в рационе, но магний часто упускается из виду. Две трети нервов, связанных с мозгом, находятся в пищеварительном тракте. В состоянии стресса желудок останавливает пищеварение. Поэтому многие люди в состоянии стресса не принимают пищу. Но магний может успокоить нервы, а, следовательно, и возобновить пищеварение.
Если у вас слабость, вполне возможно, что это вызвано дефицитом магния. Его недостаток приводит к снижению уровня энергии в орг а низме. Но с правильным "топливом" (диета, богатая магнием), большим количеством минералов и витаминов у вас будет достаточно энергии. Магний также защищает и укрепляет кости. Учитывая это, важно употреблять пищу богатую этим веществом, и, в случае необходимости, принимать добавки.
Таким образом, магний необыкновенно важен и для общего здоровья, и для снижения веса. Без достаточного количества магния в организме невозможно похудеть.
Свойства натрия. Натрий
На́трий
(Natrium)
Na, химический элемент I группы периодической системы Менделеева; атомный номер 11, атомная масса 22,9898; серебристо-белый мягкий металл, на воздухе быстро окисляющийся с поверхности. Природный элемент состоит из одного стабильного изотопа23Na.
Историческая справка. Природные соединения Н. — поваренная соль NaCI, сода Na2CO3— известны с глубокой древности. Название «натрий», происходящее от араб. натрун, греч. nitron, первоначально относилось к природной соде. Уже в 18 в. химики знали много др. соединений Н. Однако сам металл был получен лишь в 1807 Г. Дэви электролизом едкого натра NaOH. В Великобритании, США, Франции элемент называется Sodium (от исп. слова soda — сода), в Италии — sodio.
Распространение в природе. Н. — типичный элемент верхней части земной коры. Среднее содержание его в литосфере 2,5% по массе, в кислых изверженных породах (граниты и др.) 2,77, в основных (базальты и др.) 1,94, в ультраосновных (породы мантии) 0,57. Благодаря изоморфизму Na+и Ca2+, обусловленному близостью их ионных радиусов, в магматических породах образуются натриево-кальциевые полевые шпаты (плагиоклазы). В биосфере происходит резкая дифференциация Н.: осадочные породы в среднем обеднены Н. (в глинах и сланцах 0,66%), мало его в большинстве почв (среднее 0,63%). Общее число минералов Н. 222. Na слабо задерживается на континентах и приносится реками в моря и океаны, где его среднее содержание 1,035% (Na — главный металлический элемент морской воды). При испарении в прибрежно-морских лагунах, а также в континентальных озёрах степей и пустынь осаждаются соли Н., формирующие толщи соленосных пород. Главные минералы, являющиеся источником Н. и его соединений, — галит (каменная соль) NaCI, чилийская селитра NaNO3, тенардит Na2SO4, мирабилит Na2SO4·10H2O, трона NaH (CO3)2․2H2O. Мировая добыча Н. оценивается 1․108 т . Na — важный биоэлемент, в живом веществе в среднем содержится 0,02% Na; в животных его больше, чем в растениях.
Калий интересные факты. Веселые факты о калии 2019 - Healthy Miss
Калий - это минерал, который работает с натрием, чтобы регулировать баланс жидкостей в организме. Согласно Национальным институтам здравоохранения, большинство людей могут легко получить рекомендуемую суточную дозу калия через свой рацион, делая добавки ненужными. Калий можно найти в различных природных источниках с достаточно широким диапазоном, чтобы удовлетворить любой вкус, включая бананы, морковь, цитрусовые, орехи, картофель, молоко и сардины. Факты, связанные с калием, показывают, что это важно для жизни на Земле, даже если они не потребляются в составе сбалансированной диеты.
Изобилие в Земле и теле
Калий является восьмым по численности обильным минералом в атмосфере и еще более обильно представлен внутри тела. Согласно «Медицинскому советнику» единственными минералами с большим присутствием в организме человека, чем калий, являются кальций и фосфор. «Это высокое количество калия связано с его высоким качеством в обеспечении функционирования организма. Калий необходим для метаболизма углеводов, секретирования инсулина поджелудочной железой и синтезирующего белка.
Продукты с большим количеством калия, чем бананы
Бананы часто находятся в верхней части списка, когда ссылаются на природные источники калия, но ряд других продуктов содержат более высокий процент калия, некоторые из них что может быть удивительно. Даты, изюм и притязания являются лучшими источниками калия. В верхней части списка продуктов с высоким содержанием калия выпекают картофель, сырую маниоку, сок чернослива и сушеные персики, согласно «Советнику по профилактике». «
Дефицит растения
Калий является важным питательным процессом задолго до того, как он пробивается в ваше тело. Растениям нужен калий, чтобы процветать, а растение с дефицитом калия столь же болезненно, как и тело с дефицитом калия. Вы можете сказать, не увеличивают ли ваши растения достаточное количество калия, когда листья становятся серыми, желтыми или коричневыми, а края начинают скручиваться. Калийные дефициты в растениях обычно происходят во второй половине сезона в результате использования минерала при выращивании фруктов.
Почему калий символизируется K
Химический символ для калия является одним из тех вариантов, которые, похоже, не имеют столь очевидного смысла, как другие символы. Калий получил свой периодический табличный символ «К» в результате латинского производного «калий», по имени его происхождения, «поташ». «
Использование калия
Использование калия в организме включает регуляцию сердечного сокращения и мышечного сокращения, а также сохранение функций клеток. Калий также широко используется вне организма различными путями. Йодирующие свойства калия делают его полезным для производства как фейерверков, так и взрывчатых веществ.Калий используется для разработки фотографий, приготовления лекарств и йодирования соли.