Кислота разъедающая стекло. Какая кислота разъедает стекло
- Кислота разъедающая стекло. Какая кислота разъедает стекло
- Самая сильная кислота. Карборановая кислота
- Плавиковая кислота сильная или слабая. Разница между Плавиковой кислотой и Соляной кислотой
- Плавиковая кислота нейтрализация. Как правильно утилизировать кислоты
- Плавиковая кислота и стекло. Плавиковая кислота. Свойства и применение плавиковой кислоты
- Видео КИСЛОТА, РАСТВОРЯЮЩАЯ СТЕКЛО!
Кислота разъедающая стекло. Какая кислота разъедает стекло
Еще из курса школьной химии мы помним, что все мензурки и колбы в школьной лаборатории были сделаны из стекла, поскольку оно не вступает в реакцию с большинством активных соединений, таких как кислоты.
Кислоты взаимодействуют в основном с металлами, щелочами и солями, а стекло - это уже окисленный кремний, окислить его второй раз не получится .
Кроме того, кремний и кислород с стекле связаны очень прочно, и разорвать такую связь очень трудно.
Чем же она лучше или может быть сильнее?
Вовсе нет, просто процесс идет немного по другому.
Атомы кислорода во время реакции замещаются фтором, который является еще более сильным окислителем ( SiO2+4HF=SiF4(стрелка вверх) +2H2O ). На выходе получается тетрахлорид кремния (газ) и вода.
Название «плавиковая» происходит от названия минерала - плавикового шпата (СаF2), из которого получают фтороводород.
Уникальной особенностью плавиковой кислоты является способность растворять стекло.
Поэтому плавиковую кислоту хранят не в стеклянной посуде, а в сосудах с пластиковым или тефлоновым покрытием.
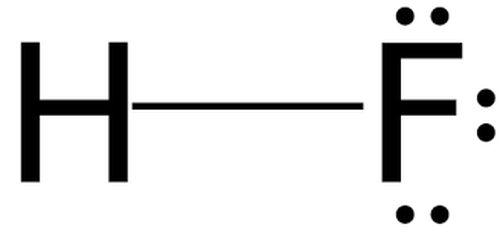 Плавиковая кислота, хотя и не является сильной кислотой, сильно ядовита
Плавиковая кислота, хотя и не является сильной кислотой, сильно ядовита Обладает слабым наркотическим действием.
При попадании на кожу в первый момент не вызывает сильной боли, легко и незаметно всасывается, но через короткое время вызывает отёк, боль, химический ожог и общетоксическое действие.
Симптомы от воздействия слабо концентрированных растворов могут появиться через сутки и даже более после попадания их на кожу.
При этом антидоты практически отсутствуют.
Поэтому при получении кожей смертельной дозы фтороводорода человек может жить несколько суток на обезбаливающих, но без надежды на спасение.
Самая сильная кислота. Карборановая кислота
| Карборановая кислота | |
|---|---|
| ( {{{картинка}}}) | |
| Общие | |
| Систематическое наименование | 2,3,4,5,6,7,8,9,10,11,12-ундекахлор-1-карба-клозо-додекаборан(12) |
| Хим. формула | H(CHB11Cl11) |
| Приведены данные для(25 °C, 100 кПа), если не указано иное. |
2,3,4,5,6,7,8,9,10,11,12-Ундекахлор-1-карба-клозо-додекаборан(12) (журналистское название Карборановая кислота ) — одна из самых сильных кислот ( суперкислота ), полученных в начале XXI века.
Получена реакцией 1-триэтилсилил-2,3,4,5,6,7,8,9,10,11,12-ундекахлор-1-карба-клозо-додекаборана(12) с газообразным хлороводородом.
Бесцветное сильно гигроскопичное кристаллическое вещество. Может быть перегнано в высоком вакууме. С водой и влагой воздуха образует соль гидроксония. Не действует на стекло. Как сильная кислота может действовать на кожу, но ее натриевая соль малотоксична. Как сильная кислота может реагировать с металлами до водорода с образованием солей и выделением водорода.
Карборановая кислота приблизительно в миллион раз сильнее концентрированной серной кислоты . В обычных шкалах измерить силу кислоты не удается, так как кислота протонирует все известные слабые основания и все растворители, в которых она растворяется.
Протонирует бензол, давая стабильную соль бензолия. Протонирует фуллерен-60, диоксид серы.
На данный момент, сильнейшей известной кислотой, которую можно хранить в лаборатории является фторированная карборановая кислота .
Кислота создана в университете Калифорнии ( США ) при участии сотрудников Института катализа СО РАН ( Новосибирск ). Идея синтеза карборановой кислоты родилась из фантазий «о молекулах, никогда прежде не создаваемых», — сказал Кристофер Рид, один из её создателей, в интервью службе новостей Nature .
- 11Cl11) // «Journal of the American Chemical Society». — 2006. — № 128 (10). — Сс. 3160—3161.
Плавиковая кислота сильная или слабая. Разница между Плавиковой кислотой и Соляной кислотой
Ключевое различие между Плавиковой кислотой и Соляной кислотой состоит в том, что Плавиковая кислота является слабой кислотой , тогда как Соляная кислота является сильной кислотой. Кроме того, Плавиковая кислота способна образовывать водородные связи, в то время как Соляная кислота не способна образовывать водородные связи.
Еще одно важное различие между Плавиковой кислотой и Соляной кислотой заключается в их молекулярной структуре. Молекула Плавиковой кислоты имеет ион фтора, тогда как молекула соляной кислоты имеет ион хлора. Кроме того, плавиковая и соляная кислоты являются донорами протонов. Следовательно, эти молекулы кислоты могут ионизироваться в водных средах с выделением протонов (H+). Эти протоны вызывают кислотность в водной среде.
- Обзор и основные отличия
- Что такое Плавиковая кислота
- Что такое Плавиковая кислота
- В чем разница между Плавиковой кислотой и Соляной кислотой
- Заключение
Что такое Плавиковая кислота?
Плавиковая кислота — это раствор фтористого водорода с водой. Фтористый водород представляет собой кислотное соединение, имеющее химическую формулу HF и молярную массу 20 г/моль. Кроме того, эта кислота является исходным соединением практически для всех фторсодержащих соединений. Пример: тефлон. Эта кислота обладает высокой химической активностью по отношению к стеклу и умеренно активной по отношению к металлам. Поэтому она хранится в пластиковых контейнерах. К онтейнер из тефлона слегка проницаем для этой кислоты.

Плавиковая кислота
Плавиковая кислота является слабой кислотой, так как она имеет более низкую константу диссоциации. Диссоциация этой кислоты дает ионы гидрония (комбинация протонов и молекул воды образуют ионы гидрония) и ионы фтора. Среди галогенводородных кислот это единственная слабая кислота. П олучают эту кислоту путем добавления концентрированной серной кислоты к минеральному флюориту (CaF2).
Что такое Соляная кислота?
Соляная кислота представляет собой водный раствор хлористового водорода. Хлористый водород имеет химическую формулу HCl, её молярная масса составляет 36,5 г/моль. Эта кислота имеет резкий запах. Она применяется в качестве исходного соединения для многих неорганических химических веществ, таких как винилхлорид.

Соляная кислота
В отличие от HF, HCl является сильной кислотой, которая может полностью ионизироваться в водной среде, образуя ионы гидроксония и ионы хлорида. Таким образом, эта кислота имеет высокое значение Ka. Получают эту кислоту, из газообразного хлороводорода путём растворения его в воде.
В чем разница между Плавиковой кислотой и Соляной кислотой?
Плавиковая кислота — это раствор фтористого водорода с водой. Это слабая кислота, и она может образовывать водородные связи. Соляная кислота — водный раствор хлористового водорода. Это сильная кислота, и она не может образовывать водородные связи.
Кроме того, молекула Плавиковой кислоты имеет ион фтора, тогда как молекула Соляной кислоты имеет ион хлора. При этом, обе они являются галогенводородными кислотами, у которых атом водорода связан с галогеном. Плавиковая кислота является единственной слабой кислотой среди других галогеноводородных кислот.
Заключение — Плавиковая кислота против Соляной кислоты
Плавиковая и Соляная кислота являются галогенводородными кислотами, так как оба этих кислотных соединения имеют галогенид, связанный с атомом водорода. Разница между Плавиковой кислотой и Соляной кислотой заключается в том, что Плавиковая кислота является слабой кислотой и может образовывать водородные связи, тогда как Соляная кислота является сильной кислотой и не способна образовывать водородные связи.
Плавиковая кислота нейтрализация. Как правильно утилизировать кислоты
Важно! Известно, что кислоты являются ядовитыми. При неаккуратном обращении с ними, при попадании их на кожу или внутрь организма могут произойти ожоги, сильные отравления и даже летальный исход.
Процесс, касающийся утилизации таких агрессивных сред на предприятиях, начинается с емкости, в которой эти вещества перевозятся и хранятся. Требования к таре при утилизации:
- Строго должны соблюдаться условия герметичности тары (она должна быть полностью герметичной), на нее должна быть нанесена специальная маркировка.
- Контейнер должен быть изготовлен из материала, инертного по отношению к перевозимым в нем веществам во избежание повреждения самого контейнера.
- Запрещается осуществлять смешивание разных кислот.
- Транспортировка тары с агрессивными отходами должна производиться специальным транспортом.
Поступившие на переработку кислотные отходы нейтрализуют (обезвреживают) с помощью реагентов, что позволяет снизить концентрацию отработанных соединений до допустимого уровня. Если в «отработке» содержатся твердые примеси, то их следует отделить. Отделение производят с помощью реакционного аппарата, который имеет мешалку и камерный фильтр-пресс. Осадок, полученный в ходе процесса отделения, обычно вывозят на полигоны опасных отходов или подвергают захоронению. Оставшуюся жидкость, в зависимости от состава отработанной кислоты, направляют на дальнейшую переработку либо уничтожают.

Отработанные синильная кислота, плавиковая кислота, пикриновая кислота также подвергаются утилизации в соответствии с особенностями происходящего процесса (для каждого вещества) по всем правилам техники безопасности. Утилизация азотной кислоты протекает по описанной выше общей технологии с учетом некоторых нюансов.
Об особенностях утилизации других распространенных кислотных отходов рассказано ниже.

Плавиковая кислота и стекло. Плавиковая кислота. Свойства и применение плавиковой кислоты

Плавиковая кислота и флюорит . Где взаимосвязь? На этот вопрос ответили шведский химик Карл Шееле и англичанин Джозеф Пристли.
Сам камень был известен еще Георгию Агриколе – отцу минералогии, жившему в 15-ом веке. Он-то и нарек его флюоритом , от латинского fluor – «течь».

Имя объясняется применением породы в качестве флюса . Его добавка к шихте снижает температуру ее плавления.
Так древние решали проблему обработки металлов. А где пригодилась названая по аналогии с камнем кислота , и чем, собственно, она является?
Что такое плавиковая кислота
Формула плавикового шпата – CaF2. В кислоту переходит лишь фтор , соединяясь с водородом. Получается фтороводород.
То есть, у плавиковой кислоты формула HF. Промышленниками, как правило, используется раствор. Но, соединение может быть и безводным.
Такую форму впервые получили Гей Люссак и Жозеф Луи. Это французские химик и физик. Безводную плавиковую кислоту они представили миру в 1810-ом году.
Когда-то, растворы плавиковой кислоты стали двойным открытием. Фтор, находящийся в составе соединения, был не известен ученым.
Работая с кислотой, они поняли, что по активности вещество подобно хлору . Название нового элемента «фтор» закрепилось лишь в России , переводится с греческого, как «разрушающий». В остальном мире элемент именуют флюором.
Внешне фтороводород можно определить лишь по туману, который газообразное соединение образует с влажным воздухом.
Выдает безводную кислоту и запах. У фтора он сильный и резкий. В остальном, фтороводород неуловим, поскольку бесцветен, смешивается с атмосферой.
Водный раствор фтороводорода тоже бесцветен, по консистенции жидкий. Плотность плавиковой кислоты равна 1,2 грамма на кубический сантиметр.
Показатель воды меньше лишь на 0,1 грамма на кубический сантиметр. Поэтому, есть риск перепутать соединение с чистой водой.
Последствия могут быть катастрофическими. Плавиковая кислота – опасность для человека. Почему? Об этом поговорим в следующей главе.
Свойства плавиковой кислоты
Фтороводород считается самой сильной из кислот, уступая в реакционности лишь царской водке .
Последняя, является смесью реактивов. В царской водке соединились сильные азотная и соляная кислоты.
Сила плавиковой кислоты демонстрируется в воздействии на стекло . Это инертный материал, не подвластный другим кислотам.
Плавиковая же стекло плавит. Это заметил еще Шванквард — немецкий химик, живший в 17-ом столетии. Проводя опыты, он использовал сосуд из флюорита.
Налив в него однажды серную кислоту, он заметил, что стеклянная крышка начала плавиться. Реагент в сосуде не мог произвести такое действие.
Значит, в серной кислоте частично растворился плавиковый шпат, и что-то из его состава стало разъедать крышку. Этот вывод Шванкварда, собственно, и стал причиной поиска новой кислоты.
Если растворившись в соляной кислоте соль плавиковой кислоты разъела стекло, что мешает ей разъесть органику?
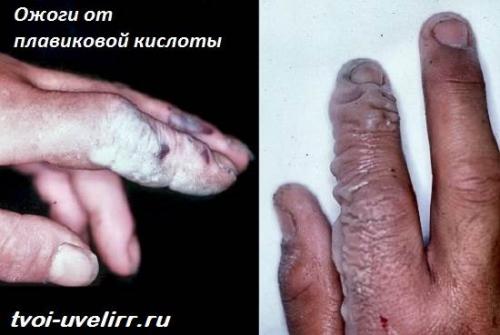
Ничего. Попадая на кожу и слизистые, реагент разрушает их. Итогом становятся ожоги. Более того, реагент и его пары запускают мутагенные процессы в крови .
Выявлен слабый наркотический эффект. Все вкупе дает 2-ой класс опасности. Он присвоен кислоте официально.
Попадая на кожу, фторводород не вызывает мгновенной боли. Соединение незаметно всасывается клетками.
Отек начинается примерно через 5-10 минут. Одновременно приходит боль, химический ожог.
Если контакт связан со слабым раствором реагента, симптомы могут проявиться, лишь через сутки.
Антидота, то есть, противоядия, нет. Получив смертельную дозу фтороводорода, надежды на спасение нет. Продержаться получается лишь несколько дней, и то на наркотиках.
Разъедая стекло , прочие силикатные материалы, органику, плавиковая кислота не вступает во взаимодействие с пластиком.
Именно в нем реагент и транспортируют. Не взаимодействует с фтороводородом и парафин.
Можно ли заменить тару из него или полиэтилена металлической? Зачастую, нет. Фтороводород вступает в реакцию с большинством металлов.
Среди немногих исключений – свинец . Но, он слишком тяжел и дорогостоящ, чтобы быть альтернативой пластику.
Остается узнать, куда везут плавиковую кислоту, где она пригождается, если столь опасна.
Применение плавиковой кислоты
Плавиковая кислота применение , естественно, находит в стекольной промышленности.
Реагент используют для химической полировки изделий и освобождения металлических деталей от примесей кварца и керамики.
Поскольку кремний плавиковая кислота плавит, обрабатывать можно и хрусталь , убирая с его поверхности все шероховатости.
В качестве протравливающего вещества реагент используют, так же, в зуботехнической отрасли.
Плавиковая кислота в стоматологии убирает с внутренней стороны керамических протезов лейцит.
Это породообразующий минерал магматического происхождения. Он – часть металлической подложки под слоем керамики.