Хлор интересные факты. Интересные факты о хлоре
- Хлор интересные факты. Интересные факты о хлоре
- Химические свойства хлора. Урок №62. Положение галогенов в периодической таблице и строение их атомов. Хлор. Физические и химические свойства хлора. Применение.
- Интересные факты о фосфоре и его соединениях. Белый фосфор: свойства, история открытия и применение
- Интересные факты о фторе. Применение фтора
- Интересные факты о галогенах. 9 фактов о йоде
- Йод интересные факты. Иод: факты и фактики
Хлор интересные факты. Интересные факты о хлоре
 Хлор является газом, находящимся в группе галогенов, и обладает рядом интересных свойств и применений.
Хлор является газом, находящимся в группе галогенов, и обладает рядом интересных свойств и применений.
Узнайте больше о применении хлора в качестве продукта для очистки воды в бассейнах и используйте во многих потребительских продуктах, таких как отбеливатели. Продолжайте читать для многих более интересных фактов хлора.
Химический элемент Хлор имеет символ С1 и атомный номер 17.
На периодической таблице Хлор находится в группе галогенов и является вторым самым легким галоидным газом после фтора.
В стандартном виде хлор является желто-зеленым газом, но его общие соединения обычно бесцветны. Хлор имеет сильный отличительный запах, такой как запах домашнего отбеливателя.
Название Chlorine происходит от греческого слова chloros, что означает зеленовато-желтый.
Хлор имеет точку плавления -150,7 ° F (-101,5 ° C) и температуру кипения -29,27 ° F (-34,04 ° C).
Свободный хлор редко встречается на Земле. Хлор сочетается с почти всеми элементами для создания соединений хлора, называемых хлоридами, которые гораздо более распространены.
Есть более 2000 естественных органических соединений хлора.
Наиболее распространенное соединение хлора известно с древних времен, это натрий хлорид, который мы знаем лучше, как «обычная соль».
Шведский химик Карл Вильгельм Шееле открыл Хлор в 1774 году, полагая, что в нем содержится кислород. В 1810 году сэр Хамфри Дэви попробовал тот же эксперимент и пришел к выводу, что хлор был на самом деле элементом, а не соединением.
Хлор является третьим наиболее распространенным элементом в океанах Земли (около 1,9% от массы морской воды — это хлорид-ионы) и 21-й наиболее распространенный химический элемент в земной коре.
Высокие окислительные свойства хлора показали, что он используется для очистки воды в США еще в 1918 году. Сегодня хлор и его различные соединения используются в большинстве плавательных бассейнов по всему миру, чтобы содержать их в чистоте и во многих бытовых чистящих средствах, таких как дезинфектанты и отбеливатели.
Хлор также используется в ряде других промышленных и потребительских продуктов, таких как производство пластмасс, отбеливание текстильных изделий, фармацевтических препаратов, хлороформ, инсектицидов, бумажных продуктов, растворителей, красителей и красок.
В высоких концентрациях хлор чрезвычайно опасен и ядовит. Он также тяжелее воздуха, поэтому может заполнить замкнутые пространства. Из-за этих фактов хлор был первым газообразным химическим веществом, используемым в качестве оружия в войне, когда обе стороны время от времени рассеивали его в низинных окопах и траншеях Первой мировой войны.
Химические свойства хлора. Урок №62. Положение галогенов в периодической таблице и строение их атомов. Хлор. Физические и химические свойства хлора. Применение.
Галогены (от греч. halos - соль и genes - образующий) - элементы главной подгруппы VII группы периодической системы: фтор, хлор, бром, йод, астат. В свободном состоянии галогены образуют вещества, состоящие из двухатомных молекул F2, Cl2, Br2, I2.
1) Общая электронная конфигурация внешнего энергетического уровня - nS 2 nP 5 . 2) С возрастанием порядкового номера элементов увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства (увеличиваются металлические свойства); галогены - сильные окислители, окислительная способность элементов уменьшается с увеличением атомной массы. Хлор Cl 2 - открыт К. Шееле в 1774 г.
Физические свойства Газ желто-зеленого цвета, t °пл. = -101° C , t °кип. = -34°С. Получение Окисление ионов Cl - сильными окислителями или электрическим током: MnO 2 + 4 HCl → MnCl 2 + Cl 2 + 2 H 2 O 2 KMnO 4 + 16 HCl → 2 MnCl 2 + 5 Cl 2 + 2 KCl + 8 H 2 O Опыт K 2 Cr 2 O 7 + 14 HCl → 2 CrCl 3 + 2 KCl + 3 Cl 2 + 7 H 2 O Электролиз раствора NaCl (промышленный способ): 2 NaCl + 2 H 2 O → H 2 + Cl 2 + 2 NaOH Химические свойства Хлор - сильный окислитель. 1) Реакции с металлами: 2Na + Cl2→ 2NaCl Ni + Cl2→ NiCl2 2 Fe + 3 Cl 2 → 2 FeCl 3 Опыт 2) Реакции с неметаллами: H 2 + Cl 2 свет или t → 2 HCl Опыт 2 P + 3 Cl 2→ 2 PCl З Опыт 3) Реакция с водой: Cl 2 + H 2 O ↔ HCl + HClO 4) Реакции со щелочами: Cl 2+ 2 KOH → KCl + KClO + H 2 O 3 Cl 2+ 6 KOH t → 5 KCl + KClO З+ 3 H 2 O 5) Вытесняет бром и йод из галогеноводородных кислот и их солей. |
Интересные факты о фосфоре и его соединениях. Белый фосфор: свойства, история открытия и применение
ФОСФОР ПЭ
«Без фосфора нет мысли»
Содержится в мозговой ткани и костях человека.
Входит в состав минерального удобрения суперфосфат.
Красный фосфор используется в производстве спичек.
История открытия фосфора.
Древние фолианты сохранили для нас отдельные эпизоды из жизни отставного солдата и гамбургского купца. Звали его Хенниг Бранд (ок. 1630-?). Его купеческие дела шли не блестяще, и именно по этой причине он сремился выбраться из нищеты. Она его ужасно угнетала. И Бранд решил попытать счастья в алхимии. Тем более что в XVII в. в отличие от нашего XX в. считалось вполне возможным найти «философский камень», который способен превращать неблагородные металлы в золото.
Хенниг Бранд
Бранд провел уже множество опытов с различными веществами, но ничего дельного у него не получалось. Однажды он решил провести химический эксперимент с мочой. Выпарил ее почти досуха и оставшийся светло-желтый осадок смешал с углем и песком, нагревая в реторте без доступа воздуха. В результате Бранд получил новое вещество, которое обладало удивительным свойством-светиться в темноте.
Так в 1669 г. был открыт фосфор, играющий исключительно важную роль в живой природе: в растительном мире, в организме животных и человека.
Счастливый ученый не замедлил воспользоваться необычным свойством нового вещества и стал демонстрировать светящийся фосфор знатным особам за довольно высокое вознаграждение. Все, что соприкасалось с фосфором, приобретало способность светиться. Достаточно было помазать фосфором пальцы, волосы или предметы, и они вспыхивали таинственным голубовато-белым светом. Религиозно и мистически настроенные богатые люди того времени диву давались, смотря на различные манипуляции Бранда с этим «божественным» веществом. Он ловко использовал огромный интерес ученых и широкой публики к фосфору и стал продавать его по цене, превосходившей даже стоимость золота. X. Бранд производил фосфор в больших количествах и держал способ его получения в строжайшей тайне. Никто из других алхимиков не мог проникнуть в его лабораторию, и поэтому многие из них стали лихорадочно ставить различные опыты, стремясь раскрыть секрет изготовления фосфора.
Интересные факты о фторе. Применение фтора
- Для фторирования воды, зубных паст и даже молока для детей.
- В фармацевтике используется во многих лекарственных средствах для лечения щитовидной железы, сахарного диабета, рака, глаукомы, ревматизма, заболеваний бронхов, малярии, стрепто- и стафиллококковых инфекций, психических заболеваний (галоперидол, флуоксетин). А также в обезболивающих препаратах, средствах для наркоза. Различные формы фторида натрия применяются для восполнения недостатка фтора в организме, для лечения и профилактики кариеса. Фторуглеводороды используются как кровезаменители.
- В сельском хозяйстве — входит в состав средств для борьбы с грызунами и другими вредителями.
- Для резки металла во фтористоводородных горелках (t горения фтора в водороде +3700 °С), а также в горелках, использующих соединения хлора и фтора; трехфтористого фтора, азота и водорода.
- Для получения производных фтора, например, фторидов вольфрама и ванадия.
- Фтороводород (плавиковая кислота) применяется в стекольной (для травления стекла), химической (сырье, катализатор, растворитель), нефтяной, пищевой, металлургической, авиационной, целлюлозно-бумажной и других отраслях.
- В высоковольтной электротехнике применяется шестифтористая сера SF6 в качестве газообразного изолятора.
- Шестифтористый уран UF6 — крайне востребованное соединение для выделения урана-235 для атомных станций и военной промышленности.
- В металлургии гексафторалюминат натрия Na3
используется как электролит при получении алюминия. - Из фторида магния изготавливают линзы и призмы для специализированных оптических приборов.
- Фторопласты являются производными фторорганических соединений. Очень востребованы в металлургии, машино- и авиастроении, радиоэлектронике, электротехнике, медицине, текстильпроме, строительстве, в космической и военной отраслях.Используются при изготовлении антипригарной посуды, химически стойкой посуды и многого другого.
- Фреоны 14 и 12 используются в качестве хладагентов в холодильниках и кондиционерах. Их применяют для тушения пожаров, в качестве смазочных материалов, инертных растворителей, как сырье для производства полимеров.
- Соединения фтора с кислородом или галогенами применяются как составная часть ракетного топлива.
Самый активный неметалл позволил создать совершенно инертные химические соединения: фторопласты и фреоны.
позволил создать совершенно инертные химические соединения: фторопласты и фреоны.
Фторопласты (тетрафторэтилены) называют органической платиной за их стойкость к химическим веществам, низко- и высокотемпературным воздействиям. Знаменитый тефлон, использующийся для изготовления антипригарной посуды, изоляционных, смазочных материалов, человеческих имплантатов и многих других продуктов — это фторопласт. В нашем блоге есть подробная статья, посвященная этим удивительным материалам.
Фреон-14 CF4 и фреон-12 CF2Cl2 считаются одними из самых безопасных хладагентов. Они очень стабильны, инертны при взаимодействии с сильными окислителями, абсолютно пожаробезопасны (не горят даже в кислородной атмосфере).
 |  |
| Колба, фторопласт | Натрий фтористый |
Применение фтора
Интересные факты о галогенах. 9 фактов о йоде

Йод — это химический элемент, который вы найдете в йодированной соли и в повседневной пище. В небольших объемах йод необходим в человеческом рационе. Каждому человеку будет полезна подборка интересных фактов о йоде. При этом не следует забывать, что у некоторых людей выражена индивидуальная непереносимость йода, а его избыток в организме ведет к практически тем же последствиям, что и йододефицит. В домашних условиях, используя аптечный раствор йода, можно наблюдать интереснейшую реакцию «йодные часы».
Для начала — девять фактов о йоде. За основу этой увлекательнейшей подборки фактов был взят материал, который изложила на страницах химического раздела ресурса About.com доктор наук Энн Мари Хельменстайн.
1. Название йода происходит от греческого слова «йодес», означающего фиолетовый, фиалковый цвет. Дело в том, что именно таким цветом обладает йод в газообразной форме.
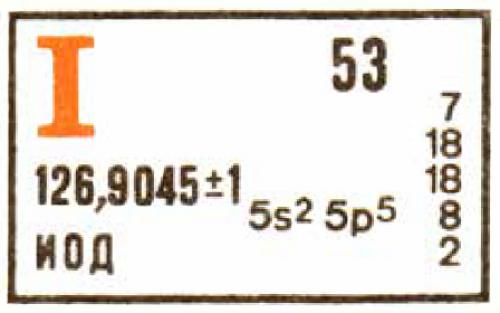
2. Известно много изотопов йода. Все они радиоактивны, кроме изотопа I-127.
3. В твердом состоянии йод черный с оттенком синевы и блестящий. При нормальных температуре и давлении йод переходит в газообразное состояние. В жидкой форме этот элемент не встречается.
4. Йод относится к галогенам, неметаллическим веществам. При этом он обладает и некоторыми свойствами, характерными для металлов.
5. Щитовидной железе йод необходим для выработки гормонов тироксина и трийодтиронина. Недостаток йода ведет к опуханию щитовидной железы. Недостаточность йода считается главной причиной задержки умственного развития. Симптомы при избытке йода подобны возникающим при недостаточности этого элемента. Йод более токсичен для людей с дефицитом селена.
6. Йод образует двухатомные молекулы с химической формулой I2.
7. Йод активно используется в медицине. У некоторых людей есть химическая чувствительность к йоду. При нанесении им на кожу йода может образовываться сыпь. В редких случаях использование йода может привести к анафилактическому (аллергическому) шоку.
8. Естественным источником йода в рационе человека являются морепродукты, ламинарии (морская капуста), растущие в богатых йодом морских водах. Калиевый йод нередко добавляют в столовую соль. Так получается известная многим кулинарам йодированная соль.
9. Атомное число йода — 53. Это означает, что каждый атом йода содержит 53 протона.
Энциклопедия Британника рассказывает о том, как человечеством был обнаружен йод. В 1811 году французский химик Бернар Куртуа, нагревая золу морских водорослей в серной кислоте, увидел фиолетовый пар. Конденсировавшись, этот пар стал черной кристаллической субстанцией, которую назвали «вещическим элементом, сходеством X». В 1813 году британский химик сэр Гемфри Дэви, будучи по пути в Италию проездом в Париже, предположил, что «вещество X» является химным с хлором и предложил назвать его йодином (англ. «iodine» — «йод») за фиолетовый цвет его газообразной формы.
Йод никогда не встречается в природе в свободном состоянии и не концентрируется в достаточных для формирования самостоятельного минерала количествах. Йод содержится в морской воде, но в небольших количествах в качестве иона I− в составе соли йодистоводородной кислоты (йодида). Содержание йода — примерно 50 миллиграмм на одну метрическую тонну (1000 килограммов) морской воды. Он также находится в морских водорослях, устрицах и печени трески, обитателях соленых вод. Человеческий организм содержит йод в составе гормона тироксина, вырабатываемого щитовидной железой.
Единственным естественным изотопом йода является стабильный йод-127. Активно используется радиоактивный изотоп йод-131 с периодом полураспада восемь дней. Он применяется в медицине для проверки функций щитовидной железы, для лечения зоба и рака щитовидной железы. А также для локализации мозга и печени.
Какие богатые йодом морепродукты известны вам? Считаете ли вы морскую кулинарию не только полезной, но и вкусной? Считается, что водоросли нори, которые используются в приготовлении суши, содержат слишком много йода, и поэтому вредны для человека. Как эта информация влияет на ваше отношение к модной нынче японской кухне и влияет ли вообще?
Йод интересные факты. Иод: факты и фактики
Шихман С.М.
Зачем нужен иод человечеству?
Сегодня ежегодное потребление иода в мире огромно — 25 тысяч тонн! Он сам или его соединения могут быть лекарством, радиоактивным веществом, добавкой для увеличения срока службы подшипников и компонентом изделий радиоэлектроники, катализатором, помощником криминалиста, реагентом, способным вызвать дождь, и многим другим.
Когда открыли иод?
Именно в 2014 году исполняется 200 лет с момента, когда этот элемент впервые назвали «иодом» (это слово по-гречески значит «фиолетовый»). Произошло это во времена наполеоновских войн. Франции требовалось много пороха, изготовляли его из селитры с добавлением высушенных морских водорослей. На одном из военных заводов произошел странный случай. Забравшаяся в лабораторию кошка опрокинула сосуд с серной кислотой на компоненты будущего пороха. Внезапно появился дым фиолетового цвета, осевший в виде черных блестящих кристаллов. Диковинное явление заинтересовало химика Бернара Куртуа, который сообщил о нем коллегам. Их общими усилиями был выделен химически чистый иод — элемент, по свойствам близкий к хлору, но менее активный.
Что известно о иоде сегодня?
В земной коре залежей чистого иода нет, что и неудивительно: этот элемент хорошо растворим в воде и легко испаряется. Однако немалые его количества присутствуют в чилийских селитряных копях и в сопутствующих водах японских газовых месторождений. Эти две страны — основные поставщики иода, причем на долю Чили приходится более половины мирового производства. Кроме того, иод содержится в сопутствующих водах нефтяных месторождений ив глубинных подземных водах. В России иод добывали на Краснокамском и Славянско-Троицком месторождениях, но из-за низкой рентабельности он проиграл тому, что поставляют из Чили, Азербайджана и Туркмении; оба производства в начале 2000-х годов закрыли. Еще есть известное с 1966 года Тюменское месторождение, но его разработке мешает проблема сброса сточных вод: их надо закачивать обратно в пласт, а это дорого. Основной же резервуар иода на Земле — Мировой океан, где это вещество в наибольшей концентрации накапливается в водорослях и других живых организмах. При испарении морской воды соединения иода разносятся ветрами и оседают преимущественно в почвах прибрежной полосы. В континентальной и особенно в гористой местности его мало.
К чему приводит недостаточность иода?
Когда иода в почве мало, вся пищевая цепочка от растений до людей оказывается иододефицитной. Это отрицательно отражается на здоровье. Первым на проблему дефицита иода обратил внимание Наполеон, который дал задание выяснить, почему во французской части Швейцарии некого призывать в армию? Целые деревни были там полны глухих, слабоумных, физически недоразвитых и уродливых людей. У большинства имелся зоб. Ответ на этот вопрос смог дать только через 40 лет врач и ботаник Гаспар Шатен. Он первым установил связь между низким содержанием иода в природе и заболеваниями человека, назвав эти болезни эндемическими (то есть характерными для определенных районов). Однако его открытие получило признание намного позже, лишь в конце XIX века. И только тогда европейцы смогли объяснить, почему еще за много веков до новой эры китайские врачи рекомендовали при зобе употреблять в пищу морские растения.
Насколько распространен дефицит иода?
По данным Всемирной организации здравоохранения, сегодня каждый третий человек живет на территориях с пониженным содержанием иода, а значит, нужны специальные мероприятия, восполняющие этот дефицит. Цель: довести суточное потребления иода у маленьких детей до 40 микрограммов, а у взрослых — до 150 мкг (при беременности — 200 мкг). Особенно иод необходим развивающемуся плоду, а также ребенку первых лет жизни и подростку в период полового созревания. При этом речь идет о миллионных долях грамма. С детьми надо быть предельно осторожным, ведь 2—3 грамма иода — смертельная доза для взрослого человека!
