Кислота растворяющая стекло. Сверхкислота
Кислота растворяющая стекло. Сверхкислота
Сверхкислота́ (или су̀перкислота́ ) — вещество или смесь веществ, параметр кислотности которых превышает кислотность 100%-ой серной кислоты . В данном случае параметр кислотности принимается как способность кислоты протонировать произвольное основание и фактически совпадает с функцией кислотности . Для 100 % серной кислоты параметр кислотности составляет H 0 = −11,93 . Наличие воды снижает кислотность сверхкислот, так как в присутствии воды сила кислоты ограничивается кислотностью иона гидроксония H3O+.
Термин суперкислота (используемый в англоязычной литературе) введён Джеймсом Конантом в 1927 году для классификации более сильных кислот, чем обычные минеральные кислоты . В 1994 году Джордж Ола был удостоен Нобелевской премииза своё исследование суперкислот и их применения в прямом наблюдении карбкатионов .
Магическая кислота получила своё название за исключительную способность растворять воск. Она является смесью пентафторида сурьмы , который является кислотой Льюиса , и фторсульфоновой кислоты — кислоты Брёнстеда . Одной из сильнейших суперкислотных систем является гексафторсурьмяная кислота - смесь плавиковой кислоты и пентафторида сурьмы . В этой системе плавиковая кислота выделяет протон (H+), а сопряжённое основание (F−) изолируется координационной связью с пентафторидом сурьмы . Так образуется большой октаэдрический анион (SbF6−), являющийся очень слабым нуклеофилом и очень слабым основанием . Став «свободным», протон обусловливает сверхкислотность системы. Фторсурьмяная кислота в 2⋅1019раз сильнее 100%-ой серной кислоты .
Для характеристики кислотности веществ в неводных средах используют функцию кислотности Гаммета Н 0 . Известны жидкости, для которых Н 0 более отрицательна, чем для концентрированных водных растворов очень сильных кислот, таких, как HNO3, Н2SO4. Эти жидкости называются сверхкислотами. Примеры: 100%-ная H2SO4( Н 0 = −12 ), безводная фторсульфоновая кислота HSO3F ( Н 0 = −15 ), смесь HF и SbF5 ( Н 0 = −28 ), 7%-ный раствор SbF5в HSO3F ( Н 0 = −19,4 ). Эквимолярную смесь HSO3F и SbF5называют « магической кислотой ». Сверхкислотность обусловлена исключительной слабостью взаимодействия с протоном соответствующих анионов (HSO4−, SbF6−и др.). В среде сверхкислот протонируются вещества, обычно не проявляющие основных свойств, в частности углеводороды. Это явление используют на практике, преимущественно в органическом синтезе ( алкилирование по Фриделю — Крафтсу , гидрирование нефти и др.).
К простым суперкислотам относят трифторметансульфоновую (CF3SO3H), хлорную , хлорсульфоновую , пентафторэтансульфоновую , фторсульфоновую (FSO3H) кислоты. Во многих случаях суперкислота является не одиночным соединением, а смесью соединений, совмещаемых для достижения высокой кислотности.
Карборановая кислота — одна из самых сильных кислот , из тех, которые можно хранить в бутылках. Она в миллион раз сильнее концентрированной серной кислоты. Создана в университете Калифорнии ( США ) при участии сотрудников Института катализа СО РАН ( Новосибирск ). Самой сильной сверхкислотой из всех, на данный момент, является фторированная карборановая кислота .
Сильнейшей известной кислотой среди всех систем является ион гидрида гелия , но данную систему невозможно хранить в сколько-нибудь заметном количестве.
К сверхкислотам Льюиса относятся большинство пентафторидов металлов и трифторид бора .
- М. : Большая российская энциклопедия, 2004—2017.
Плавиковая кислота сильная или слабая. Плавиковая кислота. Свойства и применение плавиковой кислоты
Плавиковая кислота и флюорит . Где взаимосвязь? На этот вопрос ответили шведский химик Карл Шееле и англичанин Джозеф Пристли.
Сам камень был известен еще Георгию Агриколе – отцу минералогии, жившему в 15-ом веке. Он-то и нарек его флюоритом , от латинского fluor – «течь».

Имя объясняется применением породы в качестве флюса . Его добавка к шихте снижает температуру ее плавления.
Так древние решали проблему обработки металлов. А где пригодилась названая по аналогии с камнем кислота , и чем, собственно, она является?
Что такое плавиковая кислота
Формула плавикового шпата – CaF2. В кислоту переходит лишь фтор , соединяясь с водородом. Получается фтороводород.
То есть, у плавиковой кислоты формула HF. Промышленниками, как правило, используется раствор. Но, соединение может быть и безводным.
Такую форму впервые получили Гей Люссак и Жозеф Луи. Это французские химик и физик. Безводную плавиковую кислоту они представили миру в 1810-ом году.
Когда-то, растворы плавиковой кислоты стали двойным открытием. Фтор, находящийся в составе соединения, был не известен ученым.
Работая с кислотой, они поняли, что по активности вещество подобно хлору . Название нового элемента «фтор» закрепилось лишь в России , переводится с греческого, как «разрушающий». В остальном мире элемент именуют флюором.
Внешне фтороводород можно определить лишь по туману, который газообразное соединение образует с влажным воздухом.
Выдает безводную кислоту и запах. У фтора он сильный и резкий. В остальном, фтороводород неуловим, поскольку бесцветен, смешивается с атмосферой.
Водный раствор фтороводорода тоже бесцветен, по консистенции жидкий. Плотность плавиковой кислоты равна 1,2 грамма на кубический сантиметр.
Показатель воды меньше лишь на 0,1 грамма на кубический сантиметр. Поэтому, есть риск перепутать соединение с чистой водой.
Последствия могут быть катастрофическими. Плавиковая кислота – опасность для человека. Почему? Об этом поговорим в следующей главе.
Свойства плавиковой кислоты
Фтороводород считается самой сильной из кислот, уступая в реакционности лишь царской водке .
Последняя, является смесью реактивов. В царской водке соединились сильные азотная и соляная кислоты.
Сила плавиковой кислоты демонстрируется в воздействии на стекло . Это инертный материал, не подвластный другим кислотам.
Плавиковая же стекло плавит. Это заметил еще Шванквард — немецкий химик, живший в 17-ом столетии. Проводя опыты, он использовал сосуд из флюорита.
Налив в него однажды серную кислоту, он заметил, что стеклянная крышка начала плавиться. Реагент в сосуде не мог произвести такое действие.
Значит, в серной кислоте частично растворился плавиковый шпат, и что-то из его состава стало разъедать крышку. Этот вывод Шванкварда, собственно, и стал причиной поиска новой кислоты.
Если растворившись в соляной кислоте соль плавиковой кислоты разъела стекло, что мешает ей разъесть органику?
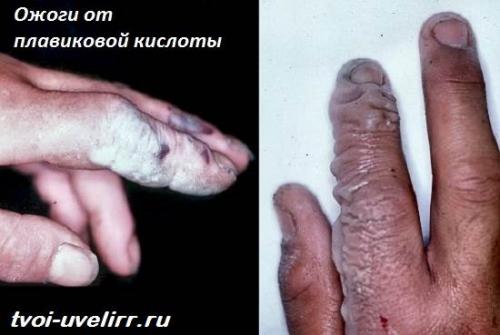
Ничего. Попадая на кожу и слизистые, реагент разрушает их. Итогом становятся ожоги. Более того, реагент и его пары запускают мутагенные процессы в крови .
Выявлен слабый наркотический эффект. Все вкупе дает 2-ой класс опасности. Он присвоен кислоте официально.
Попадая на кожу, фторводород не вызывает мгновенной боли. Соединение незаметно всасывается клетками.
Отек начинается примерно через 5-10 минут. Одновременно приходит боль, химический ожог.
Если контакт связан со слабым раствором реагента, симптомы могут проявиться, лишь через сутки.
Антидота, то есть, противоядия, нет. Получив смертельную дозу фтороводорода, надежды на спасение нет. Продержаться получается лишь несколько дней, и то на наркотиках.
Разъедая стекло , прочие силикатные материалы, органику, плавиковая кислота не вступает во взаимодействие с пластиком.
Именно в нем реагент и транспортируют. Не взаимодействует с фтороводородом и парафин.
Можно ли заменить тару из него или полиэтилена металлической? Зачастую, нет. Фтороводород вступает в реакцию с большинством металлов.
Среди немногих исключений – свинец . Но, он слишком тяжел и дорогостоящ, чтобы быть альтернативой пластику.
Остается узнать, куда везут плавиковую кислоту, где она пригождается, если столь опасна.
Применение плавиковой кислоты
Плавиковая кислота применение , естественно, находит в стекольной промышленности.
Реагент используют для химической полировки изделий и освобождения металлических деталей от примесей кварца и керамики.
Поскольку кремний плавиковая кислота плавит, обрабатывать можно и хрусталь , убирая с его поверхности все шероховатости.
В качестве протравливающего вещества реагент используют, так же, в зуботехнической отрасли.
Плавиковая кислота в стоматологии убирает с внутренней стороны керамических протезов лейцит.
Это породообразующий минерал магматического происхождения. Он – часть металлической подложки под слоем керамики.
Карборановая кислота
| Карборановая кислота | |
|---|---|
| ( {{{картинка}}}) | |
| Общие | |
| Систематическое наименование | 2,3,4,5,6,7,8,9,10,11,12-ундекахлор-1-карба-клозо-додекаборан(12) |
| Хим. формула | H(CHB11Cl11) |
| Приведены данные для(25 °C, 100 кПа), если не указано иное. |
2,3,4,5,6,7,8,9,10,11,12-Ундекахлор-1-карба-клозо-додекаборан(12) (журналистское название Карборановая кислота ) — одна из самых сильных кислот ( суперкислота ), полученных в начале XXI века.
Получена реакцией 1-триэтилсилил-2,3,4,5,6,7,8,9,10,11,12-ундекахлор-1-карба-клозо-додекаборана(12) с газообразным хлороводородом.
Бесцветное сильно гигроскопичное кристаллическое вещество. Может быть перегнано в высоком вакууме. С водой и влагой воздуха образует соль гидроксония. Не действует на стекло. Как сильная кислота может действовать на кожу, но ее натриевая соль малотоксична. Как сильная кислота может реагировать с металлами до водорода с образованием солей и выделением водорода.
Карборановая кислота приблизительно в миллион раз сильнее концентрированной серной кислоты . В обычных шкалах измерить силу кислоты не удается, так как кислота протонирует все известные слабые основания и все растворители, в которых она растворяется.
Протонирует бензол, давая стабильную соль бензолия. Протонирует фуллерен-60, диоксид серы.
На данный момент, сильнейшей известной кислотой, которую можно хранить в лаборатории является фторированная карборановая кислота .
Кислота создана в университете Калифорнии ( США ) при участии сотрудников Института катализа СО РАН ( Новосибирск ). Идея синтеза карборановой кислоты родилась из фантазий «о молекулах, никогда прежде не создаваемых», — сказал Кристофер Рид, один из её создателей, в интервью службе новостей Nature .
- 11Cl11) // «Journal of the American Chemical Society». — 2006. — № 128 (10). — Сс. 3160—3161.