Интересные факты о сере химия. Металл против монахов
Интересные факты о сере химия. Металл против монахов
Антимониум - серебристо-белый металл, среди химиков больше известный как сурьма. Этот металл известен уже много тысяч лет. Например, археологами доказано, что примерно три тысячи лет назад в Вавилоне из сурьмы делали сосуды. Но чаще, конечно, применялся не чистый металл, а его сульфид - «сурьмяный блеск».
В 1604 году появилось первое описание получения сурьмы из соединений. Это описание было в книге довольно известного монаха, а по совместительству алхимика, Василия Валентина.
Василий Валентин верил, что соединения сурьмы могут помочь очистить организм от «вредоносных начал». Он пытался применять сурьму в качестве лекарства. Например, он считал отличным «рвотным средством» вино, которое было выдержано в сурьмяных сосудах. А как вам «вечные пилюли», которые можно было использовать много раз - они просто проходили весь кишечный тракт? Все эти лекарства Василий использовал на монахах, и некоторых из них забирала мучительная смерть. Вот откуда взялось название «антимониум» - противомонашеский металл.

Сегодня есть мнение, что такого человека как Василий Валентин не существовало, ведь его не было в списках монахов ордена, к которому он себя причислял. Вполне возможно, что все его книги - коллективный труд нескольких алхимиков.
И ещё интересный факт про сурьму: в России это название произошло от турецкой косметической процедуры - «чернение бровей». И хотя в качестве краски для бровей сурьму употребляли редко, выражение насурьмить брови» довольно часто можно было услышать в быту.
Сообщение о сере. Сера
Се́ра — элемент шестой группы третьего периода главной подгруппы периодической системы химических элементов , с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S (лат. Sulfur). В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде.
История открытия
Сера (англ. Sulfur, фр. Soufre, нем. Schwefel) в самородном состоянии, а также в виде сернистых соединений известна с древнейших времён. С запахом горящей серы, удушающим действием сернистого газа и отвратительным запахом сероводорода человек познакомился, вероятно, ещё в доисторические времена. Именно из-за этих свойств сера использовалась жрецами в составе священных курений при религиозных обрядах. Сера считалась произведением сверхчеловеческих существ из мира духов или подземных богов. Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников. Около VIII в. китайцы стали использовать её в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что её считали «принципом горючести» и обязательной составной частью металлических руд. Пресвитер Теофил (XII в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, ещё в древнем Египте. В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов. В дальнейшем она стала одним из трёх принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения её из пиритов; последний был распространён в древней Руси. Впервые в литературе он описан у Агриколы. Таким образом, точно происхождение серы не установлено, но, как сказано выше, этот элемент использовался до Рождества Христова, а значит знаком людям с давних времён.
Сера и ее свойства. Описание и свойства
Сера представляет собой вещество, которое находится в таблице Менделеева в 16 группе, под третьим периодом и имеет атомный номер – 16. Она может встретиться как в самородном, также и в связанном виде. Обозначается сера литерой S. Известна формула серы – (Ne)3s23p4. Сера как элемент входит в состав многих белков.

Если говорить о строении атома элемента серы , то на внешней его орбите есть электроны, валентное число которых достигает шести.
Это объясняет свойство элемента быть максимально шестивалентным в большинстве объединений. В структуре природного химического элемента есть четыре изотопа, и это – 32S, 33S, 34S и 36S. Говоря о внешней электронной оболочке, атом имеет схему 3s2 3р4. Радиус атома – 0,104 нанометра.
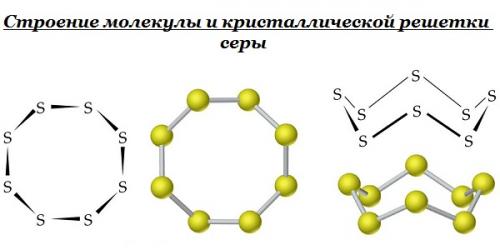
Свойства серы в первую очередь делятся на физического типа. К нему относится то, что элемент имеет твердый кристаллический состав. Два аллотропических видоизменения – основное состояние, в котором устойчив этот элемент серы.
Первое видоизменение ромбическое, имеющее лимонно-желтую окраску. Его устойчивость ниже, чем 95,6 °С. Второй – моноклинный, имеющий медово-желтую окраску. Его устойчивость колеблется от 95,6 °С и 119,3 °С.

На фото минерал сера
Во время плавки химический элемент стает движущейся жидкостью, имеющей желтый цвет. Она буреет, достигая температуры более 160 °С. А при 190 °С цвет серы превращается в темно-коричневый. После достижения отметки 190 °С наблюдается уменьшение вязкости вещества, которое все же после нагревания 300 °С стает жидкотекучим.
Другие свойства серы:
- Практически не проводит тепла и электричества.
- Не растворяется при погружении в воду.
- Растворима в аммиаке, имеющем безводную структуру.
- Также растворима в сероуглероде и других растворителях, имеющих органическую природу.
К характеристике элемента серы важно добавить и ее химические особенности. Она является активной в этом отношении. Если серу нагреть, то она может просто объединяться практически с любым химическим элементом.

На фото образец серы, добытый в Узбекистане
За исключением инертных газов. При контакте с металлами, хим. элемент образовывает сульфиды. Комнатная температура способствует тому, что элемент может вступить в реакцию с ртутью . Увеличенная температура способствует увеличению активности серы.
Рассмотрим, как поведение серы с отдельными веществами:
- С металлами – является окислителем. Образовывает сульфиды.
- С водородом – при высоких температурах – до 200 °С происходит активное взаимодействие.
- С кислородом. Образовывается объединения оксидов при температурах до 280 °С.
- С фосфором, углеродом – является окислителем. Только при отсутствии воздуха во время реакции.
- С фтором – проявляет себя как восстановитель.
- С веществами, имеющими сложную структуру – также как восстановитель.