Стекло и плавиковая кислота. Какая кислота разъедает стекло
Стекло и плавиковая кислота. Какая кислота разъедает стекло
 Еще из курса школьной химии мы помним, что все мензурки и колбы в школьной лаборатории были сделаны из стекла, поскольку оно не вступает в реакцию с большинством активных соединений, таких как кислоты. Кислоты взаимодействуют в основном с металлами, щелочами и солями, а стекло - это уже окисленный кремний, окислить его второй раз не получится. Кроме того, кремний и кислород с стекле связаны очень прочно, и разорвать такую связь очень трудно.
Еще из курса школьной химии мы помним, что все мензурки и колбы в школьной лаборатории были сделаны из стекла, поскольку оно не вступает в реакцию с большинством активных соединений, таких как кислоты. Кислоты взаимодействуют в основном с металлами, щелочами и солями, а стекло - это уже окисленный кремний, окислить его второй раз не получится. Кроме того, кремний и кислород с стекле связаны очень прочно, и разорвать такую связь очень трудно.
Единственная кислота, способная разъесть стекло, - плавиковая, представляющая собой водный раствор фтороводорода (HF). Чем же она лучше или может быть сильнее? Вовсе нет, просто процесс идет немного по другому. Атомы кислорода во время реакции замещаются фтором, который является еще более сильным окислителем ( SiO2+4HF=SiF4(стрелка вверх) +2H2O ). На выходе получается тетрахлорид кремния (газ) и вода.
Название «плавиковая» происходит от названия минерала - плавикового шпата (СаF2), из которого получают фтороводород. Уникальной особенностью плавиковой кислоты является способность растворять стекло. Поэтому плавиковую кислоту хранят не в стеклянной посуде, а в сосудах с пластиковым или тефлоновым покрытием.
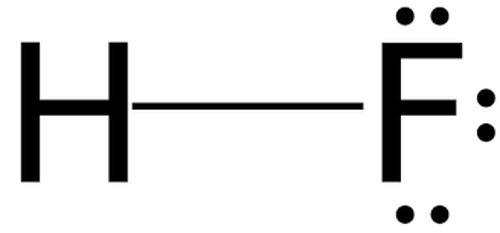 Плавиковая кислота, хотя и не является сильной кислотой, сильно ядовита и обладает слабым наркотическим действием. При попадании на кожу в первый момент не вызывает сильной боли, легко и незаметно всасывается, но через короткое время вызывает отёк, боль, химический ожог и общетоксическое действие. Симптомы от воздействия слабо концентрированных растворов могут появиться через сутки и даже более после попадания их на кожу. При этом антидоты практически отсутствуют, поэтому при получении кожей смертельной дозы фтороводорода человек может жить несколько суток на обезбаливающих, но без надежды на спасение.
Плавиковая кислота, хотя и не является сильной кислотой, сильно ядовита и обладает слабым наркотическим действием. При попадании на кожу в первый момент не вызывает сильной боли, легко и незаметно всасывается, но через короткое время вызывает отёк, боль, химический ожог и общетоксическое действие. Симптомы от воздействия слабо концентрированных растворов могут появиться через сутки и даже более после попадания их на кожу. При этом антидоты практически отсутствуют, поэтому при получении кожей смертельной дозы фтороводорода человек может жить несколько суток на обезбаливающих, но без надежды на спасение.
В промышленности плавиковая кислота используется для травления стекла, очистки от породы при добыче редких металлов и многих других областях.
Плавиковая кислота сильная или слабая. Сильные и слабые реагенты
Если реагент в водном растворе полностью распадается на ионы, то есть диссоциирует, то оно является сильным, поскольку слабые химические соединения никогда не растворяются до конца.

Кроме того, отличить слабую кислоту можно посредством измерения её проводимости. Сильные соединения являются хорошими электролитами. Сильные основания при попадании в воду также распадаются. Следует отметить, что основания также называют гидроксидами или гидроокисями.
Существует специальные перечни слабых и сильных кислот и оснований. Таблица, приведённая ниже, также может использоваться для классификации реагентов.
| Сильная кислота | Слабая кислота | Сильное основание | Слабое основание |
|---|---|---|---|
| HCI соляная или хлороводородная | HF фтороводородная | NaOH гидроокись натрия | Mg(OH)2 гидроокись магния |
| HBr бромоводородная | CH3COOH уксусная | KOH гидроокись калия | Fe(OH)2 гидроокись железа (II) |
| HI йодоводородная | H2SO3 сернистая | Ca(OH)2 гидроокись кальция | Zn(OH)2 гидроокись цинка |
| HNO3 азотная | H2S сероводородная | Ba(OH)2 гидроокись бария | NH4OH гидроокись аммония |
| HClO4 хлорная | HNO2 азотистая | LiOH гидроокись лития | |
| H2SO4 серная | H2SiO3 кремниевая |
А также следует отметить, что кислородсодержащая угольная (H2CO3) и ортофосфорная (H3PO4) или фосфорная кислоты — слабые. К сильным же необходимо добавить хромовую, которая является средней по силе.
Кроме того, нужно учитывать, что современная химия позволяет учёным создавать новые соединения. В связи с этим список кислот, как сильных, так и слабых, постоянно пополняется.
Плавиковая кислота и металл. Свойства и применение плавиковой кислоты
(фтороводородная/фтористоводородная/гидрофторидная кислота) – это вещество неорганической этимологии, раствор гидрофторида в воде, 1-основная кислота. Промышленный выпуск осуществляется в разных концентрациях: 40 % (наиболее распространенный вариант), 50 % и 72 %. Наименование веществу дал плавиковый шпат – сырье для получения рассматриваемой кислоты.
Молярная масса – 20,0063 г/моль, плотность – 1,15 г/см³. Термосвойства: t плавления – -83,55 °C, t кипения – 85,8 °C. Формула: HF.
Свойства плавиковой кислоты
Физические . Это жидкий не имеющий окраса легкоподвижный материал. Запах – острый, обжигающий. При сочетании с водой смешивается. Растворение фтороводорода в воде приводит к возникновению весьма большого количества тепла (59,1 кДж/моль). Получается продукт с 38,6 % (37,5 %) HF, азеотропная смесь, которая кипит при 114 °C (109 °C). Он является результатом работы как с высококонцентрированным, так и с разбавленным веществом.
Небольшие температурные параметры – предусловие формирования соединений, не отличающихся стойкостью, при контакте гидрофторида и воды.
Химические . Гидрофторидная кислота принадлежит к средне сильным кислотам. Она способна разъедать стекло и прочие силикаты (это единственная кислота, реагирующая с оксидом кремния – основой всех силикатных материалов), поэтому хранение и перевозку нужно осуществлять в ПЭ, ни в коем случае не в стеклянных емкостях. Реакция протекает с выделением фторида кремния в газообразном состоянии.
Плавиковая кислота реагирует с различными металлами, при этом формируются фториды. Растворению в ней не поддаются свинец, платина, золото и палладий. Отсутствует ее влияние и на такие материалы, как, каучук, полиэтилен, фторопласт и прочие пластики. Если ее концентрация не превышает 60 %, то воздействия не происходит и на железо.
Еще одно интересное свойство данного вещества заключается в замерзании воды при более низкой t, если внести в нее HF.
Токсические . Фтороводородная кислота не горючая, но осуществляет сильное токсическое влияние на людей и окружающую среду. Она не только ядовита, но и характеризуется наркотическим воздействием. Может стать причиной острых отравлений, внести негативные изменения в пищеварительный тракт, кровь и органы кроветворения, а также привести к отеку легких. Проникнув в кровь сквозь кожу, может связывать кальций и нарушать деятельность сердечно-сосудистой системы.
Чревата пагубными последствиями при вдыхании, раздражением кожных покровов и слизистых оболочек, обладает кожно-резорбтивной и эмбриотоксичностью, имеет мутагенное действие и способна накапливаться в организме.
Сама кислота, как и чистый фтороводород, принадлежит ко 2-му классу опасности по воздействию на внешнюю среду.
Нужно соблюдать осторожность, так как при начальном контакте с кожей фтористоводородная кислота может не вызывать обильных болевых ощущений, продолжая при этом потихоньку и незаметно всасываться. Но пройдет некоторое время – и во всей силе проявят себя химические ожоги, боли, отеки и общий токсический эффект.
Плавиковая кислота: применение
Высокочистый и технический материал различных концентраций находит применение во многих отраслях. Основные из них следующие:
– стекольное производство (прозрачное травление кремниевого стекла, удаление шероховатости из поверхности хрусталя);
– нефтехимия и горнодобывающее направление (обработка и очистка поверхностей, увеличение эффективности добычи нефти путем изъятия асфальтовых и парафиновых отложений, разрушение пород, содержащих кремний);
– химия (выделение ряда металлов, в частности Ta, Zr и Nb, катализ некоторых хим. процессов, в частности при алкилировании в реакции изобутана и олефина, а также изготовление фторлонов,, содержащих фтор кислот, боратов и фторидов, орган. соединений на основе F, искусственных смазок и пластмасс);
– аналитическая химия (растворение силикатных соединений);
– алюминиевая промышленность (изготовлениеэлектролитическим методом и работа с ним);
– металлообработка (входит в состав композиций, предназначенных для травления и полирования, электрохим. обработки сплавов и нержавейки, используется при очищении заготовок из металла от песка и керамических примесей);
– полупроводниковая отрасль (очищение и травление кремния для полупроводников);
– стоматология и зуботехническое дело (изъятие с внутренней стороны протезов из керамики лейцита, плюс выступает протравливающим веществом и элементом металлического каркаса под керамические коронки, обеспечивающим надежную фиксацию);
– создание фильтровальных систем.
Как видите, несмотря на свою опасность, плавиковая кислота ввиду ряда ценных физических и химических свойств очень важна для разных отраслей. Используйте ее с учетом всех требований безопасности – сведете к минимуму негативные последствия, получив при этом желаемые результаты работы.
Плавиковая кислота растворяет человека. Плавиковая кислота. Свойства и применение плавиковой кислоты
Плавиковая кислота и флюорит . Где взаимосвязь? На этот вопрос ответили шведский химик Карл Шееле и англичанин Джозеф Пристли.
Сам камень был известен еще Георгию Агриколе – отцу минералогии, жившему в 15-ом веке. Он-то и нарек его флюоритом , от латинского fluor – «течь».

Имя объясняется применением породы в качестве флюса . Его добавка к шихте снижает температуру ее плавления.
Так древние решали проблему обработки металлов. А где пригодилась названая по аналогии с камнем кислота , и чем, собственно, она является?
Что такое плавиковая кислота
Формула плавикового шпата – CaF2. В кислоту переходит лишь фтор , соединяясь с водородом. Получается фтороводород.
То есть, у плавиковой кислоты формула HF. Промышленниками, как правило, используется раствор. Но, соединение может быть и безводным.
Такую форму впервые получили Гей Люссак и Жозеф Луи. Это французские химик и физик. Безводную плавиковую кислоту они представили миру в 1810-ом году.
Когда-то, растворы плавиковой кислоты стали двойным открытием. Фтор, находящийся в составе соединения, был не известен ученым.
Работая с кислотой, они поняли, что по активности вещество подобно хлору . Название нового элемента «фтор» закрепилось лишь в России , переводится с греческого, как «разрушающий». В остальном мире элемент именуют флюором.
Внешне фтороводород можно определить лишь по туману, который газообразное соединение образует с влажным воздухом.
Выдает безводную кислоту и запах. У фтора он сильный и резкий. В остальном, фтороводород неуловим, поскольку бесцветен, смешивается с атмосферой.
Водный раствор фтороводорода тоже бесцветен, по консистенции жидкий. Плотность плавиковой кислоты равна 1,2 грамма на кубический сантиметр.
Показатель воды меньше лишь на 0,1 грамма на кубический сантиметр. Поэтому, есть риск перепутать соединение с чистой водой.
Последствия могут быть катастрофическими. Плавиковая кислота – опасность для человека. Почему? Об этом поговорим в следующей главе.
Свойства плавиковой кислоты
Фтороводород считается самой сильной из кислот, уступая в реакционности лишь царской водке .
Последняя, является смесью реактивов. В царской водке соединились сильные азотная и соляная кислоты.
Сила плавиковой кислоты демонстрируется в воздействии на стекло . Это инертный материал, не подвластный другим кислотам.
Плавиковая же стекло плавит. Это заметил еще Шванквард — немецкий химик, живший в 17-ом столетии. Проводя опыты, он использовал сосуд из флюорита.
Налив в него однажды серную кислоту, он заметил, что стеклянная крышка начала плавиться. Реагент в сосуде не мог произвести такое действие.
Значит, в серной кислоте частично растворился плавиковый шпат, и что-то из его состава стало разъедать крышку. Этот вывод Шванкварда, собственно, и стал причиной поиска новой кислоты.
Если растворившись в соляной кислоте соль плавиковой кислоты разъела стекло, что мешает ей разъесть органику?
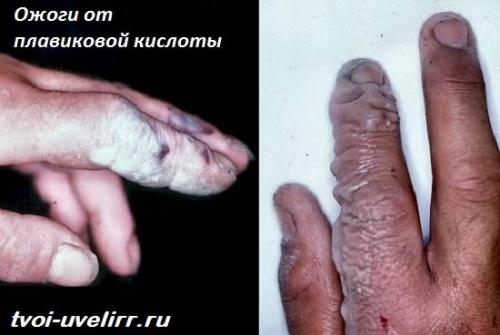
Ничего. Попадая на кожу и слизистые, реагент разрушает их. Итогом становятся ожоги. Более того, реагент и его пары запускают мутагенные процессы в крови .
Выявлен слабый наркотический эффект. Все вкупе дает 2-ой класс опасности. Он присвоен кислоте официально.
Попадая на кожу, фторводород не вызывает мгновенной боли. Соединение незаметно всасывается клетками.
Отек начинается примерно через 5-10 минут. Одновременно приходит боль, химический ожог.
Если контакт связан со слабым раствором реагента, симптомы могут проявиться, лишь через сутки.
Антидота, то есть, противоядия, нет. Получив смертельную дозу фтороводорода, надежды на спасение нет. Продержаться получается лишь несколько дней, и то на наркотиках.
Разъедая стекло , прочие силикатные материалы, органику, плавиковая кислота не вступает во взаимодействие с пластиком.
Именно в нем реагент и транспортируют. Не взаимодействует с фтороводородом и парафин.
Можно ли заменить тару из него или полиэтилена металлической? Зачастую, нет. Фтороводород вступает в реакцию с большинством металлов.
Среди немногих исключений – свинец . Но, он слишком тяжел и дорогостоящ, чтобы быть альтернативой пластику.
Остается узнать, куда везут плавиковую кислоту, где она пригождается, если столь опасна.
Применение плавиковой кислоты
Плавиковая кислота применение , естественно, находит в стекольной промышленности.
Реагент используют для химической полировки изделий и освобождения металлических деталей от примесей кварца и керамики.
Поскольку кремний плавиковая кислота плавит, обрабатывать можно и хрусталь , убирая с его поверхности все шероховатости.
В качестве протравливающего вещества реагент используют, так же, в зуботехнической отрасли.
Плавиковая кислота в стоматологии убирает с внутренней стороны керамических протезов лейцит.
Это породообразующий минерал магматического происхождения. Он – часть металлической подложки под слоем керамики.