Китай: новый этап в борьбе с коронавирусом
- Китай: новый этап в борьбе с коронавирусом
- Связанные вопросы и ответы
- Как быстро может быть разработана вакцина от нового коронавируса
- Какие технологии используются для разработки вакцины
- Сколько времени потребуется для тестирования вакцины
- Как будут производиться клинические испытания вакцины
- Сколько людей будет вакцинировано после разработки вакцины
- Как будет производиться распределение вакцины по всему миру
- Сколько стоимость разработки вакцины
- Какие организации участвуют в разработке вакцины
- Как будут контролировать эффективность вакцины
Китай: новый этап в борьбе с коронавирусом
С конца марта в Китае ежедневно фиксировалось не больше нескольких десятков новых случаев в день, и абсолютное большинство из них были завозными. Прилетающие в Китай сдают ПЦР-тест на коронавирус в аэропорту, но независимо от его результатов все они должны 14 дней находиться в карантине в отведенных для этого гостиницах или дома, если у человека есть постоянное место жительства в городе, куда он прилетел.
Условия в карантинных гостиницах могут быть далеки от шикарных: там может отсутствовать вай-фай (хотя, если у человека есть местная сим-карта, он может пользоваться быстрым китайским мобильным интернетом), кондиционеры, ресторан или кухня – в этом случае человек должен сам организовать себе доставку еды. Убирать комнаты обитатели также должны самостоятельно.
При этом власти КНР постоянно меняют правила выдачи виз и допуска в страну неграждан, ориентируясь на эпидемиологическую ситуацию в Китае и в стране вылета.
Еще один частый источник заражения – если верить китайским сообщениям – импортируемые в страну замороженные продукты. Медиа рассказывали о нескольких цепочках заражения, начинавшихся от портовых рабочих, которые разгружали или сортировали такие продукты.
Но где бы ни был найден человек с положительным тестом, как только становится известен результат анализа в месте обнаружения разворачивается поистине военная операция по поимке всех, кто еще мог подхватить вирус. И удобство тех, кто оказался в зоне боевых действий – последнее, что принимается во внимание.
Например, 8 декабря в городе Чэнду обнаружили четырех человек, чьи тесты на коронавирус оказались положительными. Уже во вторник в районе, где были найдены новые случаи, для проведения ПЦР-тестов были взяты образцы у 255 200 жителей, причем результаты 60 500 из них к утру вторника уже были готовы.
Чтобы обеспечить такую скорость, работники системы здравоохранения и добровольцы поднимали людей среди ночи, чтобы те шли на пункты взятия анализов – это стандартная практика в ситуации, когда где-то обнаруживается носитель вируса.
Другой пример – недавняя история в шанхайском аэропорту «Пудун», где у одного из рабочих 20 ноября тест на коронавирус дал положительный результат – первый случай инфекции в Шанхае за пять месяцев
Как только это стало известно, аэропорт был закрыт, у всех, кто находился в нем, включая 17 700 рабочих, взяли мазки для проведения ПЦР-тестов, и до тех пор, пока не были получены результаты, люди оставались в аэропорту.
Здесь можно посмотреть, как выглядит тестирование такой массы народа. Опасаясь, что заболевший рабочий мог контактировать с кем-то и передать ему вирус, власти закрыли весь прилегающий к аэропорту район до тех пор, пока все жители не сдадут образцы и не получат результаты ПЦР-тестов. На карантине оказались и люди, приехавшие в этот район по делам.
Газета «Жэньминь жибао» рассказала о таксисте, который привез клиента в один из микрорайонов возле аэропорта, а когда через пять минут попытался выехать из него, патруль остановил машину и сказал, что район только что закрыли на карантин.
Ночь таксист провел в автомобиле, наутро ему выделили койко-место, зубную щетку и белье, чтобы две недели карантина он мог провести с относительным комфортом. Водитель присоединился к волонтерам, но ему повезло – по итогам массового тестирования в районе не нашли ни одного нового случая COVID-19, так что 24 числа блокпосты сняли и жителям разрешили перемещаться по городу.
Связанные вопросы и ответы:
Вопрос 1: Кто начал разработку вакцины от нового коронавируса в Китае
Ответ: Разработка вакцины от нового коронавируса в Китае была начата Министерством здравоохранения Китая в сотрудничестве с ведущими научными и медицинскими учреждениями страны.
Вопрос 2: Какие организации участвуют в разработке вакцины от нового коронавируса в Китае
Ответ: В разработке вакцины от нового коронавируса в Китае участвуют такие организации, как Китайская академия наук, Китайская академия медицинских наук, Центр контроля и профилактики заболеваний Китая, а также ведущие университеты и научно-исследовательские институты страны.
Вопрос 3: Какие технологии используются при разработке вакцины от нового коронавируса в Китае
Ответ: При разработке вакцины от нового коронавируса в Китае используются современные технологии, такие как генная инженерия, рекомбинантная ДНК-технология, а также традиционные методы, основанные на использовании инактивированных вирусных частиц.
Вопрос 4: Как проходит тестирование вакцины от нового коронавируса в Китае
Ответ: Тестирование вакцины от нового коронавируса в Китае проходит в несколько этапов. Сначала проводится исследование безопасности и эффективности вакцины на животных, затем на добровольцах-здоровых людях, и, наконец, на больных новой коронавирусной инфекцией.
Вопрос 5: Какие результаты были получены при разработке вакцины от нового коронавируса в Китае
Ответ: По состоянию на данный момент, китайские исследователи сообщают о положительных результатах при разработке вакцины от нового коронавируса. Вакцина продемонстрировала высокую степень безопасности и эффективности в испытаниях на животных и добровольцах-здоровых людях.
Вопрос 6: Когда ожидается выпуск вакцины от нового коронавируса в Китае
Ответ: Ожидается, что вакцина от нового коронавируса в Китае будет выпущена в массовое производство в течение ближайших месяцев, после успешного завершения всех этапов клинических испытаний и получения необходимых разрешений от регулирующих органов.
Как быстро может быть разработана вакцина от нового коронавируса
Об эксперте: Павел Волчков — кандидат биологических наук, вирусолог, генетик, заведующий Лабораторией геномной инженерии Московского физико-технического института (МФТИ).
Существует много разных подходов к созданию вакцины от COVID-19. Она может быть вирусной, инактивированной, векторной, на основе нуклеиновых кислот. Какая из них окажется самой эффективной — пока никто точно не знает. Если вы разработчик, то можете выбрать любую и принять участие в большой мировой гонке по созданию долгожданной прививки. А можете, как ученые из МФТИ, сознательно отказаться от возможных бенефитов и неспешно заняться разработкой экспериментальной вакцины нового типа.
Одни из самых популярных на сегодняшний день — это рекомбинантные или векторные вакцины. Они изготавливаются на основе вирусов-носителей или вирусных векторов. Как это работает? Вы берете какие-то вирусные частицы, «вычищаете» из них все патогенные составляющие и на их место вставляете нужные вам элементы — генетический материал вируса, против которого изготавливается вакцина. По такому принципу была создана прививка от вирусного гепатита B или ротавирусной инфекции. И по такому же принципу сегодня многие разработчики создают вакцину от COVID-19. В частности, в России векторную вакцину от коронавируса разработали в НИИ эпидемиологии и микробиологии имени Н.Ф. Гамалеи.
Павел Волчков:
«Чем хорош вирусный вектор? Он способен инфицировать клетки только один раз и не может размножаться в организме человека дальше. Такая особенность делает рекомбинантные вакцины довольно безопасными. При этом в качестве вирусного вектора можно использовать буквально любой вирус из библиотеки человеческих патогенов. Выбор зависит от того, для какого заболевания вы изготавливаете вакцину. Потому что одни вирусы лучше заражают мышцы, другие — легкие, третьи — центральную нервную систему. Например, та же вакцина Центра Гамалеи выполнена на аденовирусном векторе».
Аденовирусы — ДНК-вирусы. Относятся к группе острых респираторных вирусных инфекций (ОРВИ) и характеризуются поражением слизистых оболочек верхних дыхательных путей, конъюнктив, лимфоидной ткани. Большинство аденовирусных инфекций представляют собой легкую форму инфицирования. Существует семь видов аденовирусов человека (от А до G) и 57 серотипов. Подразделение на серотипы связано с различными способами заражения.
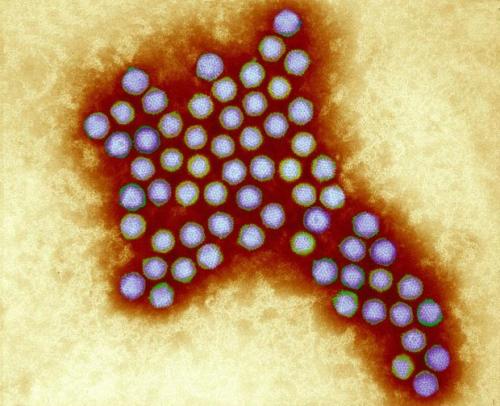
Аденовирус под микроскопом (Фото: Wellcome Images)
В качестве векторов для вакцин, аденовирусы применяются довольно давно. Эти вирусы хорошо изучены. Согласно данным сайта ClinicalTrials.gov , клинические испытания на людях успешно прошли или проходят более сотни различных вакцин на основе аденовирусных векторов.
Среди главных преимуществ этих вирусов — их естественный механизм взаимодействия с клетками человека. Они способны обеспечивать довольно длительную экспрессию антигена, а это успешно активирует врожденный иммунный ответ.
Антигены — это любые вещества, содержащиеся в микроорганизмах и других клетках (или выделяемые ими), которые несут в себе признаки генетически чужеродной информации, и которые потенциально могут быть распознаны иммунной системой организма.
Павел Волчков:
«При всех плюсах, у аденовирусов есть и ряд минусов. Первое — они обладают провоспалительным эффектом. То есть могут чрезмерно драйвить иммунную систему. Проще говоря — вызывать сильный иммунный ответ. Это один из возможных побочных эффектов вообще всех аденовирусных вакцин. Но есть еще один нюанс. Большинство аденовирусов — это естественные патогены человека. Многие из нас сталкивались в течение жизни с аденовирусными инфекциями. А что это значит? Что в крови у таких людей уже есть нейтрализирующие антитела к этому вирусу. Они могут связываться с компонентами вакцины и блокировать ее действие. Поэтому для некоторых из нас такая вакцина будет совершенно неэффективна».
Какие технологии используются для разработки вакцины
Способам введения ДНК-вакцин в организм уделяется не меньше внимания, чем созданию самих конструкций, так как от этого зависит успех иммунизации в целом. Поэтому разработаны различные, порой весьма хитроумные, методы доставки таких вакцин в организм.
Самый простой — это парентеральный способ введения , который заключается в инъекции ДНК-вакцин в солевом растворе (внутримышечно, внутрикожно). При этом бόльшая часть ДНК поступает в межклеточное пространство и только потом включается в клетки.
Использование генного пистолета . Для этого ДНК фиксируют на микроскопических золотых гранулах (около 1–2 мкм), а затем с помощью устройства, приводимого в действие сжатым гелием, гранулы «выстреливают» непосредственно внутрь клеток (рис. 4). Для данного способа доставки требуется значительно меньшее количество вводимого материала, чем для внутримышечной инъекции. Так, для инъекции мышам нужно 10-100 мкг препарата, а с использованием генного пистолета достаточно 0,1-1 мкг.
Электропорация — техника, которая с использованием электрических импульсов позволяет формировать поры в клеточной мембране и доставлять ДНК непосредственно в клетки.
Микроконтейнеры из полиматериалов . Московские ученые, например, создали пористую микросферу из карбоната кальция, покрытую несколькими слоями полисахаридов, в которую упаковывается молекула ДНК. Если микросферы в полимерной оболочке поместить в подкисленный раствор, карбонат кальция внутри растворится и уйдет через полимерную мембрану. Внутри останется только ДНК, подлежащая транспортировке. Подобных микроконтейнеров для доставки ДНК разработано не так много. Есть зарубежные аналоги, в которых оболочка капсулы выполнена из полимолочной кислоты. На их основе создают вакцины против гепатита и даже СПИДа. Средний диаметр микрокапсул для доставки ДНК-вакцин всего 1–2 микрона. Такие микрокапсулы можно ввести подкожно или даже в кровь. Если в микрочастицу вместе с ДНК или лекарством поместить фермент, расщепляющий оболочку капсулы изнутри, то высвобождением лекарства можно управлять: чем меньше фермента, тем медленнее рушится оболочка.
Липосомные носители обеспечивают высокую эффективность доставки при внутривенном введении, при этом экспрессия целевых генов значительно возрастает, так как осуществляется во многих органах, и особенно в селезенке.
ДНК-вакцины можно вводить перорально с использованием бактериальных носителей . Для этих целей применяются, например, модифицированные бактерии Shigella flexneri с делецией в гене asd . Мутантные бактерии растут in vitro на среде с диаминопимелиновой кислотой и, проникая в эукариотические клетки, не размножаются в них, так как отсутствует упомянутая кислота, а продуцируют закодированные в плазмиде антигены. Для перорального введения создан вектор на основе ослабленного штамма Salmonella , который способен к самоуничтожению в организме через определенный период времени после выполнения иммунизационных задач. Для этого бактерию модифицировали таким образом, что ее выживание стало зависеть от наличия искусственных сахаров, не встречающихся в условиях организма. После того как в клетках, зараженных генно-инженерным штаммом Salmonella , заканчивается запас специфического сахара, поставляемого вместе с вакциной, бактерии не способны сохранить целостность своих клеточных стенок, что приводит к их гибели.
Сколько времени потребуется для тестирования вакцины
Специалисты предупреждают: не все разработанные в мире вакцины окажутся эффективными. По статистике, до стадии производства доходит не более 6% экспериментальных препаратов.
«Успех экспериментальных вакцин составляет около 7% на доклинической стадии и 15–20% в ходе клинических исследований»,— говорит Сет Беркли, американский эпидемиолог, глава альянса Gavi, пропагандирующего и развивающего вакцинацию (цитата по The Telegraph).
По разным данным, в мире сейчас разрабатывается от 170 до 218 вакцин от COVID-19. ВОЗ 31 июля опубликовала данные о 26 перспективных вакцинах, которые проходят клинические испытания на людях. Большинство нацелено на выработку антител к S-протеину — это такой белковый «шип», которым вирус связывается с рецептором на мембране клетки, в которую затем проникает для размножения. В сущности, благодаря этим «шипам» коронавирус и получил свое название.
По информации ВОЗ, до третьей фазы клинических исследований дошли шесть вакцин :
- Оксфордского университета (совместно с AstraZeneca),
- Американской Moderna (совместно с Национальным институтом аллергии и инфекционных заболеваний США),
- Немецкой BioNTech (совместно с Fosun Pharma и Pfizer),
- Китайской Sinovac,
- Уханьского института вирусологии,
- Пекинского института вирусологии (обе совместно с Sinopharm).
Вакцина от CanSino Biological Inc./Beijing Institute of Biotechnology, которую планируется вводить китайским военнослужащим, пока заканчивает вторую фазу.
Самой перспективной считается оксфордская вакцина.
Это векторная вакцина на основе аденовируса шимпанзе, несущая ген коронавирусного S-белка. Эксперты ВОЗ называют ее главным претендентом. Свои первые результаты ученые Оксфорда опубликовали 20 июля в престижном медицинском журнале The Lancet : испытания на 1077 взрослых добровольцах показали, что вакцина обеспечивает двойную защиту от коронавируса, формируя и антитела, и клеточный иммунитет, которые будут усилены ревакцинацией. Серьезных побочных эффектов не отмечалось, а незначительные легко снимались парацетамолом. По сообщению The Telegraph , для дальнейшей работы Оксфорду и Имперскому колледжу Лондона, который разработал собственную вакцину от COVID-19, выделили £84 млн.
AstraZeneca еще в мае объявила о контракте на $1,2 млрд с правительством США на поставку 400 млн доз тогда даже не проверенной оксфордской вакцины, а 13 июня подписала соглашение с Евросоюзом тоже на 400 млн доз. Британское правительство согласилось оплатить 100 млн доз, рассчитывая, что 30 млн из них будут доступны жителям Соединенного Королевства уже в сентябре.
Несмотря на обнадеживающие данные, некоторые источники The Telegraph подчеркивают, что факт обеспечения долговременного иммунитета оксфордской вакциной еще не доказан. На это как раз и направлена третья фаза клинических испытаний.
Профессор Адриан Хилл, директор Института Дженнера при Оксфордском университете и один из разработчиков вакцины
Все готовы инвестировать в ее производство еще до окончания клинических исследований. Это, конечно, лестно, но не гарантирует результат. Она может провалиться, может выстрелить, а может оказаться середнячком».
Вакцина, разработанная совместно немецкой биотехнологической BioNTech и фармацевтической Pfizer, использует вирусную РНК. Первые данные исследований показали ее безопасность и способность в больших количествах генерировать антитела к SARS-CoV-2. О клеточном иммунитете информации нет.
По вакцине Moderna в медицинском издании The New England Journal of Medicine было опубликовано несколько отчетов, в том числе о ее действии на макак-резус и людей. В качестве транспорта, доставляющего вакцину в организм, здесь используются липидные наночастицы; они содержат матричную РНК коронавирусного S-протеина.
Если верить опубликованным результатам, вакцина способствует выработке количества антител, превышающего их содержание у переболевших COVID-19.
Но после повторного введения вакцины у 21% испытуемых в группе с дозой 250 мкг были отмечены серьезные побочные эффекты. Третья фаза испытаний стартовала 27 июля, и министр здравоохранения США Алекс Азар весьма оптимистичен: «Благодаря руководству президента Трампа и упорному труду американских ученых вакцина, разработанная Национальными институтами здравоохранения и компанией Moderna, подошла к третьей фазе испытаний в рекордные сроки».
Китайская биотехнологическая Sinovac тоже сообщила о положительных результатах испытаний вакцины, использующей инактивированный SARS-CoV-2. Третья фаза исследования проходит в Бразилии с участием 8870 добровольцев. Предусмотрена вакцинация в два этапа с интервалом 14 дней.
Как будут производиться клинические испытания вакцины
Разработка всякой вакцины начинается с идентификации (определения) патогенного микроорганизма и изучения его генетики, антигенов и свойств. Также разработчикам необходимо понимать механизмы иммунного ответа на данный микроб и его компоненты. Особенности ответа можно изучать как в лабораторных условиях на животных, так и при наблюдении за больными людьми (в этом случае обычно оформляется проведение клинического исследования по изучению медицинского состояния). Существуют модели для изучения особенностей микробов в лабораториях на клеточных моделях — с использованием особых клеточных культур, без лабораторных животных.
Другим важным этапом при принятии решения о разработке вакцины является выбор конструкции препарата — это, опять же, зависит от особенностей возбудителя и иммунного ответа на инфекцию. Под конструктивными особенностями подразумевается выбор пути создания вакцины — будет препарат живым или инактивированным; как будет выращиваться возбудитель для приготовления вакцины; какие антигены использовать для приготовления вакцины; как измерить иммунный ответ у привитых (обычно под этим понимают определение концентрации антител, но надо также понимать, какие антитела надо искать у привитых, каким методом, и какая концентрация антител является защитной); какова необходимая дозировка антигена для формирования адекватного иммунного ответа; сколько доз необходимо ввести для формирования иммунного ответа — в процессе разработки новых вакцин концепция может неоднократно меняться.
Следующим этапом является программа доклинических и клинических исследований, которая также зависит от особенностей микроба и клинических проявлений инфекции. Обычно программа клинических исследований вакцин должна подтвердить эффективность средства. В идеале сравнение происходит с плацебо и оценивается по клиническим точкам, например, по выработке антител после вакцинации или по предотвращению развития заболеваний и его осложнений и т.д. Но это бывает не всегда возможно. Если заболевание является очень тяжелым и смертельно опасным (например, бешенство), тогда лишение защиты участников клинического исследования признается неэтичным, и исследование проводят по оценке выраженности иммунного ответа у привитых и переносимости препарата на ограниченном контингенте участников.
Всегда при начале разработки нового препарата определяют особенности иммунного ответа и так называемые суррогатные маркеры, то есть антитела к определенному антигену в защитной концентрации. Защитную концентрацию антител к новым антигенам устанавливают на ранних этапах разработки новой вакцины. Для большинства существующих вакцин показатели иммуногенности и антигенные мишени уже известны, и при копировании (воспроизводстве) уже имеющейся вакцины процесс идет гораздо быстрее (например, при копировании вакцины против пневмококковой инфекции или гепатита B).
Сколько людей будет вакцинировано после разработки вакцины
Казалось бы, с ними нельзя не согласиться: глобальная вакцинация, действительно, должна быть синхронной. Сейчас процесс организован так, что в недостаточно охваченных прививками странах успевают сформироваться новые штаммы COVID-19, которые затем неизбежно распространяются по всему миру. Уберечься от них, как мы видим, не получается даже у богатых, географически изолированных государств, таких как Австралия, которой пришлось прибегнуть к строгому локдауну , чтобы не допустить вспышки заражений дельта-штаммом. Странам, отличающимся протяженной сухопутной границей и более коррумпированными, чем австралийские, чиновниками, избежать проникновения новых штаммов почти невозможно.
Синхронно идущая по всему миру вакцинация позволила бы задушить вирус в каждой стране и тем самым остановить глобальную фабрику новых штаммов. Однако это утверждение верно только в том случае, если мировые производители вакцин в состоянии произвести столько доз, сколько хватит всему человечеству для выработки коллективного иммунитета. Тогда равномерное распределение вакцин между странами позволило бы покончить с пандемией и добиться того, что принято называть игрой с положительной суммой.
Однако сегодня вакцину для всех произвести все еще нельзя. Спрос на прививки пока значительно превышает их предложение, и в такой ситуации многие неизбежно останутся без вакцины. Стоит ли в этом случае бороться за более равномерное распределение вакцин и тратить на это ресурсы?
Не так просто ответить на этот вопрос. Действительно, пока вакцины достаются преимущественно населению развитых стран, жителям небогатых государств во многом остается полагаться на другие способы сдерживания вируса – социальное дистанцирование, маски и локдауны. При этом последняя мера дается таким экономикам значительно тяжелее, чем богатым, располагающим большими фискальными возможностями для поддержки бизнеса и населения. А первые две становятся все менее эффективными из-за новых, более заразных, штаммов.
Однако в случае более равномерного глобального распределения вакцин, при существующих масштабах их выпуска, прививки спасали бы больше жизней в развивающихся экономиках, но при этом не доставались бы многим жителям развитых стран. Это могло бы привести к тому, что США, Великобритания или Израиль испытывали бы сегодня значительно более высокие волны заражаемости и смертности — возможно, близкие к той, что наблюдалась минувшей весной в Индии. Иными словами, более равномерное распределение вакцин без достаточного уровня их выпуска привело бы и к более равномерному распределению смертей от COVID-19. Но это уже игра с нулевой суммой, при которой жизнь в одной стране сохраняется потому, что в другой кто-то умирает от недостатка вакцин. С точки зрения глобальной борьбы с пандемией это вряд ли что-то меняет по сравнению с сегодняшними результатами.
Возможно, определенных улучшений можно было бы добиться, отказавшись от вакцинирования молодых граждан развитых государств в пользу более пожилых жителей бедных стран. Но и в этом случае между развитым и развивающимся миром неизбежна асимметрия в процессе вакцинации, ведь богатые государства, в отличие от бедных, отличаются более возрастным населением. Кроме того, некоторые новые штаммы значительно более беспощадны к молодым людям, чем первоначальная версия вируса.
Как будет производиться распределение вакцины по всему миру
У проблемы есть и очевидный экономический аспект. Гиганты фармацевтического рынка, так называемая Big Pharma, редко занимаются вакцинами. Производство вакцин, за исключением, возможно, вакцин от гриппа и вакцин от вируса папилломы человека, в последние годы считалось слабым рынком, за который конкурируют производители из развивающихся стран — например, Индии. Причина, в частности, в том, что потенциальная аудитория невакцинированных постоянно уменьшается.
Логично, что в связи с пандемией коронавируса Big Pharma вступила в гонку за создание вакцины. Но так как такие компании сфокусированы на разработке новых технологий и развивают в основном то, что можно защитить патентами, то и для вакцины выбрали модный, инновационный подход и по механизму действия, и по технологии. При этом цена объявлена порядка десятков долларов за дозу. Для сравнения, стоимость одной инъекции «Золгенсмы» (препарата для лечения спинально-мышечной атрофии) составляет около $2 млн за укол. При этом производство вакцины от производства этого препарата отличается по сути лишь масштабами. Следует упомянуть и о том, что рынок вакцины от коронавируса обещает быть высококонкурентным.
Эту проблему гиганты рынка решают разными способами. Если Pfizer, использовав для разработки вакцины экспертизу BioNTech, намерен производить ее на собственных мощностях, то Moderna планирует использовать для производства мощности контрактного производителя — компании Lonza, имеющего опыт производства гентерапевтических препаратов. Здесь следует отметить, что контрактные производители биотехнологических продуктов, подобные Lonza, в обычное «невоенное» время существуют благодаря биотех-разработчикам — как правило, стартапам. Именно поэтому такие контрактные производства убыточны не только в российских условиях, но нередко и за рубежом. Российские биотехнологические стартапы исчисляются десятками, а не сотнями и тысячами, как было бы желательно для успешной экономической схемы. Решением проблемы могло бы быть государственное финансирование контрактных производителей гентерапевтических препаратов для целей их внедрения. Однако такие подобные инициативы пока не нашли поддержки со стороны правительства и институтов развития.
Сколько стоимость разработки вакцины
Россияне не только побаиваются вакцин в целом, но и убеждены, что отечественные препараты уступают импортным. Однако стоит отметить, что стандарты качества в разных странах не различаются — отличия между, например, российским, европейским и американским GMP минимальны. GMP (сокр. от англ. Good manufacturing practice — Надлежащая производственная практика) — это стандартные требования, в них прописано, как должны быть выстроены производственные процессы и контроль качества, как должно быть подготовлено производственное помещение и так далее. В случае любых противоречий компании ориентируются на более строгие правила и на требования локального законодательства.
Есть, например, американская система контроля, европейская и евразийская. При этом в фармацевтической отрасли все время что-то развивается, появляются новые технологии. Понятно, что увеличивается число ступеней проверок — на нашем производстве пневмококковой вакцины их сейчас более трех тысяч. И все они обязательны к соблюдению. Только так можно быть уверенными в качестве препарата и его безопасност
Неманя Аранджелович директор по качеству «Петровакс»
Но самым важным звеном, конечно, являются люди, которые работают на таком производстве. Какими же качествами и компетенциями должен обладать сотрудник? По мнению опрошенных «Лентой.ру» специалистов «Петровакса», работников их компании выделяют профессиональные знания и повышенная дисциплинированность, местами граничащая с «роботизацией». Хотя, глядя на сотрудников «Петровакс», видишь просто добрых и приятных людей, которые очень любят свое дело.
Проект по локализации вакцины «Превенар® 13» позволил сотрудникам компании приобрести уникальные компетенции, а для многих послужил стартом для профессионального роста. Так, Сергей Керенцев, принимавший участие в трансфере технологий на завершающих этапах проекта, сегодня занимает пост руководителя фармпроизводства.

Фото: компания «Петровакс»
С началом пандемии COVID-19 вопрос о локальном производстве качественных препаратов встал особенно остро. Закрытие границ и трудности с цепочками поставок ударили по всем, но для фармацевтической отрасли проблемы были еще серьезнее.
Значительная часть героизма легла на наших логистов. Ведь в фармацевтике нельзя просто взять и поменять поставщика. Регламентировано все очень жестко и подробно. Поэтому приходилось учиться решать все эти проблемы — в частности, расширять пул альтернативных поставщиков и закупать все компоненты, расходные материалы с запасом. Но зато сейчас, когда отрасль столкнулась с новыми вызовами, благодаря этим резервам мы имеем возможность производить препараты на перспективу
Михаил Цыферов президент компании «Петровакс»

Фото: компания «Петровакс»
Директор фармпроизводства компании «Петровакс» Сергей Керенцев отмечает, что с первых дней пандемии для компании было важно не только обеспечить безопасность сотрудников, но и поддержать бесперебойную деятельность организации, в том числе продолжая производить необходимый объем вакцин.
Какие организации участвуют в разработке вакцины
Контроль качества вакцин на стадии разработки:
1 этап — доклинические испытания на животных . Вакцина-кандидат и все компоненты, которые используются при ее создании, проверяются на токсичность, максимальную дозу, мутагенность, переносимость при введении максимальных доз.
2 этап — клинические испытания на людях . В ходе клинических испытаний I фазы вакцину впервые проверяют на ограниченной группе людей, уточняется дозировка, схема применения препарата. Во время клинических испытаний II фазы вакцину испытывают у пациентов из групп риска по данной инфекции. Завершают стадию экспериментов клинические испытания III фазы , когда вакцина проверяется на большом числе здоровых пациентов. На всех этапах клинических исследований обязательными требованиями являются информированное согласие пациентов на участие в эксперименте и утверждение протокола этическим комитетом.
Препараты, предназначенные для вакцинации детей, подвергаются дополнительным испытаниям и лицензируются отдельно. При этом принимается во внимание, что дети первых лет жизни не могут жаловаться на недомогания, возможно связанные с поствакцинальными осложнениями.
Для правильного учета поствакцинальных осложнений проводятся испытания с обязательным включением групп плацебо, которые получают препарат, лишенный специфического иммуногена, но во всем остальном идентичный испытуемой вакцине. В целях объективности учета проводятся «слепые» испытания: вакцинные препараты и плацебо поступают на испытания в закодированном виде, а персонал, привлекаемый к регистрации поствакцинальных осложнений, не информируется о содержимом вводимого препарата до конца испытаний.
3 этап — регистрация вакцины в стране-разработчике после успешного завершения трех фаз клинических испытаний.
4 этап — лицензирование вакцины в других странах возможно только после регистрации в стране-производителе. В ходе лицензирования вакцины в стране проводится полное лабораторное и клиническое исследование вакцины, в ходе которого оценивают безопасность и иммуногенность вакцины. Для проведения контрольных испытаний выбирается группа участников исследования около 100–200 человек, для которой показана вакцинация данным препаратом.
Контроль качества вакцины на производстве. Для того чтобы произвести препарат, отвечающий всем требованиям, необходимо контролировать каждый этап производства. При изготовлении вакцины проводится также посерийный контроль ее качества. Для последнего контроля используют только методы проверки на животных. Для каждой серии вакцины на производстве выдается паспорт качества.
5 этап — постмаркетинговое (пострегистрационное) наблюдение осуществляется как государственными органами здравоохранения, так и производителями вакцин. Основная его задача — мониторинг числа тяжелых побочных реакций и осложнений, возникающих при практическом применении вакцины. Некоторые, исключительно редкие осложнения на вакцины, удается выявить только при массовом применении, поскольку частота осложнений может быть ниже, чем предельное число добровольцев в контрольных исследованиях. Пострегистрационное наблюдение также включает в себя проведение небольших клинических исследований, в ходе которых подтверждаются характеристики вакцины, проверяется ее эффективность на ограниченных группах риска, обобщаются данные о профилактической эффективности прививок. В некоторых случаях, в ходе таких исследований выявляются новые показания для прививок данной вакциной, новые группы риска, демонстрируются преимущества введения дополнительных доз или равноценность иммунитета при уменьшении числа доз и концентрации вакцины. Именно пострегистрационные исследования являются мощным стимулом для создания новых и совершенствования существующих вакцин.
Как будут контролировать эффективность вакцины
Сейчас Россия испытывает около десятка вакцин в доклинической фазе, свидетельствуют данные ВОЗ. Больше «кандидатов» представили лишь США, Китай и Канада. Для страны важна разработка собственной вакцины: она входит в топ-3 государств с самой высокой заболеваемостью коронавирусом, экономика серьезно пострадала от введенных из-за пандемии карантинных мер. Вакцины разрабатывают несколько групп российских ученых, в том числе новосибирский государственный научный центр «Вектор» Роспотребнадзора, компания «Биокард», Санкт-Петербургский НИИ вакцин и сывороток.
Сейчас к началу клинических исследований готовится вакцина, разработанная Национальным исследовательским центром эпидемиологии и микробиологии имени Гамалеи Минздрава России совместно с 48-м ЦНИИ войск радиационной, химической и биологической защиты Минобороны. Исследователи отобрали две группы добровольцев: из числа военных и из числа гражданских, и поместили на 14-дневную изоляцию. Министр обороны Сергей Шойгу в конце мая заявил, что клинические исследования вакцины завершатся до конца июля. «Предполагаемый период предоставления регистрационного досье и государственной регистрации — август. Соответственно, промышленное производство, которое они для себя предполагают, — это сентябрь», — заявила вице-премьер Татьяна Голикова в субботу, 13 июня. В случае успешных испытаний вакцина будет производиться на мощностях «Р-Фарма» в Ярославле, а соинвестором в расширение мощностей предприятия выступит Российский фонд прямых инвестиций.
В конце июня начать клинические испытания вакцины от коронавируса планирует научный центр вирусологии «Вектор», заявил его гендиректор Ринат Максютов. Центр разрабатывает шесть вариантов вакцины против COVID-19.